网址:http://m.1010jiajiao.com/timu3_id_307446[举报]
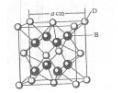
已知A、B、c、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如右图。请回答:
(1)A与c形成的共价化合物的分子式是 ,杂化轨道是____,分子的立体结构是____。
(2)B与C比较,电负性较小的是 (填元素符号);B与c形成的化合物晶体类型是 。
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,
它的+2价离子的电子排布式为 。
(4)从图中可以看出,D踉B形成的离子化合物的化学式为 ;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是 (只要求列出算式)。
查看习题详情和答案>>(1)A、B、C、D四种元素组成的化合物中既能与盐酸反应,又能与NaOH反应的相对分子质量最小的化合物的结构简式为? ?,A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式? ?,其水溶液的pH? ?7(填“>”“<”或“=”)。
(2)将ACD3的稀溶液和CA3的水溶液混合,不可能出现的结果是(填字母)? ?。?
a.pH<7,且c(H+)>c(CD-3)>c(OH-)>c(CA+4)?
b.pH<7,且c(CD-3)>c(OH-)=c(H+)>c(CA+4)
c.pH>7,且c(CA+4)>c(OH-)>c(CD-3)>c(H+)?
d.pH=7,且c(CA+4)>c(CD-3)>c(H+)>c(OH- )?
(3)A、D、E与氯四种元素中的三种组成化合物X、Y,组成元素原子个数比为1∶1∶1,其水溶液的酸碱性与CA3水溶液的相同;常温下0.1 mol·L-1?的X溶液的pH与0.1 mol·L-1?盐酸的pH之和为14;则X、Y的化学式为X ,Y 。?
(4)常温下,0.01 mol·L-1X的溶液中,水电离产生的OH-的物质的量浓度为? ? mol·L-1;相同pH的X、Y溶液,加水稀释相同倍数后,溶液的pH分别为a1、a2,则a1 a2(填“>”“<”或“=”)。?
(5)“神舟”六号发射时所用火箭推进器中盛有液态的C2A4和液态A2D2,当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知0.4 mo1 C2A4与一定量液态A2D2发生上述反应,可放出256.6 kJ的热量,则上述反应的热化学方程式为 。?
查看习题详情和答案>>(14分)
现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和,D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)元素B在周期表中的位置是 。
(2)F的单质与E的最高价氧化物对应水化物反应的化学方程式是 。
(3)C、D最低价氢化物稳定性的强弱顺序是 (填化学式) ;D、E、F原子半径的大小顺序是 (填元素符号)。
(4)在A、C、D组成的化合物中,既有离子键又有共价键的是 (填化学式)。
(5)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是 。
(6)化合物BA4D与O2、稀硫酸可组成燃料电池,此电池的负极反应式是 。
查看习题详情和答案>>
(14分)
现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和,D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)元素B在周期表中的位置是 。
(2)F的 单质与E的最高价氧化物对应水化物反应的化学方程式是 。
单质与E的最高价氧化物对应水化物反应的化学方程式是 。
(3)C、D最低价氢化物稳定性的强弱顺序是 (填化学式) ;D、E、F原子半径的大小顺序是 (填元素符号)。
(4)在A、C、D组成的化合物中,既有离子键又有共价键的是 (填化学式)。
(5)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是 。
(6)化合物BA4D与O2、稀硫酸可组成燃 料电池,此电池的负极反应式是 。
料电池,此电池的负极反应式是 。
(14分)
现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和,D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)元素B在周期表中的位置是 。
(2)F的单质与E的最高价氧化物对应水化物反应的化学方程式是 。
(3)C、D最低价氢化物稳定性的强弱顺序是 (填化学式) ;D、E、F原子半径的大小顺序是 (填元素符号)。
(4)在A、C、D组成的化合物中,既有离子键又有共价键的是 (填化学式)。
(5)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是 。
(6)化合物BA4D与O2、稀硫酸可组成燃料电池,此电池的负极反应式是 。
查看习题详情和答案>>