摘要:21 22 23 24 25
网址:http://m.1010jiajiao.com/timu3_id_30712[举报]
 在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
,该反应的基本类型是复分解反应
复分解反应
.(2)据图可知V盐酸:VNaOH溶液=
3:2
3:2
时,两溶液恰好完全反应.(3)当V盐酸:VNaOH溶液=1:4时溶液中含有的微粒有
Na+、OH-、Cl-、H2O
Na+、OH-、Cl-、H2O
(填符号).(4)在给定的坐标图上绘出溶液温度与盐酸体积的曲线图.分析曲线变化的原因
中和反应伴随的能量变化是放热,随着盐酸的增加,温度逐渐升高,到恰好反应时温度最高;随着盐酸的继续滴加,过量的盐酸会吸收溶液的热量,所以温度又逐渐降低.
中和反应伴随的能量变化是放热,随着盐酸的增加,温度逐渐升高,到恰好反应时温度最高;随着盐酸的继续滴加,过量的盐酸会吸收溶液的热量,所以温度又逐渐降低.
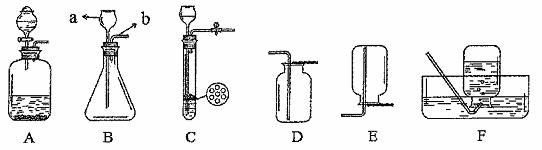
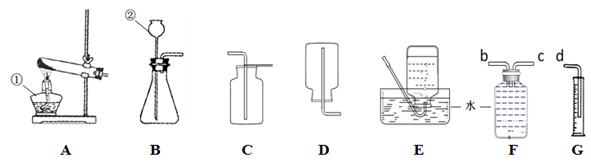
.请结合下列实验装置图回答有关问题。
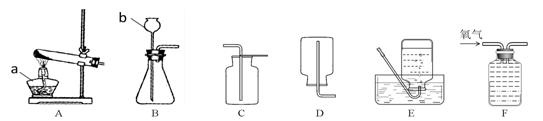
① 请写出仪器a、b的名称:a (20) b (21)
② 实验室制取并收集二氧化碳可选择的一组装置为 (22) (填字母)。
③ 用氯酸钾和二氧化锰的混合物制取氧气的化学方程式为 (23) 。为确保用E装置收集到较纯净的氧气,实验操作方面的注意事项有(写一点)(24) 。若制取的氧气用F装置收集,请将图F中的导管补画完整(25) 。
查看习题详情和答案>>