摘要:(一)必考题 26. (1).用系统命名法给下列有机物命名: CH2=C(CH3)-CH(CH3)-CH3 (2).写出下列物质的结构简式: 反-2-丁烯 ,其分子中碳原子间形成的共价键共有 个σ键 个π键. 27.有机物的结构可用“键线式 简化表示.如:CH3-CH=CH-CH3可表示为 .有一种有机物X它的键线式如下: (1)X的分子式为: ,有机物Y是X的同分异构体.且属于芳香族 化合物.则Y的结构简式是 . (2)Y可以与溴水反应.其生成物的结构简式是 , Y在一定条件下 还可生成高分子化合物.写出该反应的化学方程式 . 28.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素. A B C D E F G H I J K L M N O P 试回答下列问题: (1)请写出元素P的基态原子电子排布式 , (2)画出元素E的电子排布图 ,F氢化物的分子构型 为 ; (3)第三周期元素中.电负性最小的是 ,第一电离能最大的是 , 29.实验题.已知在常用催化剂的催化下.氢气和炔烃加成生成烷烃.难于得到烯烃.但使用活性较低的林德拉催化剂[Pd/(PdO.CaCO3).其中钯附着于碳酸钙及少量氧化铅上].可使炔烃的氢化停留在生成烯烃的阶段.而不再进一步氢化.现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置.拟由乙炔制得乙烯.并测定乙炔氢化的转化率.若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒分别与足量的X和稀硫酸反应.当反应完全后.假定在标准状况下测得G中收集到的水VmL.试回答有关问题. (1)所用装置的连接顺序是a. . . . . . .h. (2)写出A中所发生反应的化学方程式: . (3)D的作用是 . (4)为减慢A中的反应速率.X应选用 . (5)F中留下的气体除含少许空气外.还有 .G所选用的量筒 的容积较合理的是 . A.500mL B.1000mL C.2000mL (6)若V=672mL(导管内气体体积忽略不计).则乙炔氢化的转化率为 .
网址:http://m.1010jiajiao.com/timu3_id_304685[举报]
必考题高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.

(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得
mol KMnO4.
查看习题详情和答案>>

(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列
BD
BD
(填序号)物质相似.A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
2MnO2+4KOH+O2
2K2MnO4+2H2O
| ||
2MnO2+4KOH+O2
2K2MnO4+2H2O
.
| ||
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:
K2MnO4
K2MnO4
.(4)上述流程中可以循环使用的物质有石灰、二氧化碳、
KOH
KOH
和MnO2
MnO2
(写化学式).(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得
| 2 |
| 3 |
| 2 |
| 3 |
(每空2分,共10分。)
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
完成下列各题:
(1) 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误 的是________。
的是________。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)________________。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的物质发生加聚反应的反应方程式_______________。
(5)乙烯基乙炔可与HCl反应生成2-氯-1,3-丁二烯,写出2-氯-1,3-丁二烯加聚反应的反应方程式_______________。
必考题高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
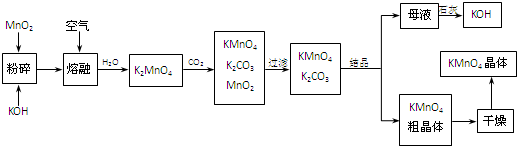
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列 (填序号)物质相似.
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: .
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: .
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 (写化学式).
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得 mol KMnO4.
查看习题详情和答案>>

(1)KMnO4稀溶液是一种常用的消毒剂.其消毒机理与下列 (填序号)物质相似.
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式: .
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: .
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 (写化学式).
(5)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得 mol KMnO4.
A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4;D的最外层电子数与次外层电子数之比为3:4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体.
请回答下列问题:
(1)D、E的最高价氧化物对应水化物的酸性较强的是
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有O.2mol电子通过时两极产生的气体在标准状况下的体积共
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,原子个数之比为1:1:1,乙溶液中水的电离程度比纯水的小.则化合物乙中的化学键类型为
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是
查看习题详情和答案>>
请回答下列问题:
(1)D、E的最高价氧化物对应水化物的酸性较强的是
HClO4
HClO4
(写化学式).(2)用惰性电极电解化合物CE的饱和溶液,当电路中有O.2mol电子通过时两极产生的气体在标准状况下的体积共
4.48
4.48
L.(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:
H2O2+H2S=2H2O+S↓
H2O2+H2S=2H2O+S↓
.(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,原子个数之比为1:1:1,乙溶液中水的电离程度比纯水的小.则化合物乙中的化学键类型为
离子键、共价键
离子键、共价键
;若丙为常见家用消毒剂的主要成分,则丙的化学式是NaClO
NaClO
.(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性时发生反应的离子方程式:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
.【必考题】
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
(2)从母液中分离出H2O2和尿素,采用的操作是
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在
②完成并配平方程式:
③根据滴定结果,可确定产品中活性氧的质量分数为:
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
查看习题详情和答案>>
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
.(2)从母液中分离出H2O2和尿素,采用的操作是
c
c
.(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在
酸
酸
式(选填:“酸”、“碱”)滴定管中.②完成并配平方程式:
2
2
MnO4-+5
5
H2O2+6
6
H+=2
2
Mn2++8
8
H2O+5O2
5O2
③根据滴定结果,可确定产品中活性氧的质量分数为:
13.3%
13.3%
.④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
偏高
偏高
(选填:“偏高”、“偏低”或“不变”).⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
尿素
尿素
.