网址:http://m.1010jiajiao.com/timu3_id_30435[举报]
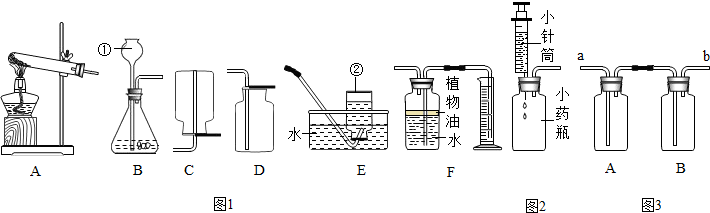
(1)写出带标号仪器的名称:①______,②______;
(它)实验室若以高锰酸钾为原料用装置A来制取氧气,则装置A需要改进的地方是______,反应的化学方程式是______.
(5)实验室可以用石灰石和稀盐酸制取CO它.此外,CO它也可以用碳酸氢钠(NaHCO5)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为______,若用此法来制取CO它,应选用的发生和收集装置是______(填序号);
(x)装置F可用来测量生成的CO它气体的体积,其中在水面上放一层植物油的目的是______,植物油上方原有的空气对实验的结果______(填“有”或“没有”)明显影响.
(5)丽丽用家里的小针筒和废药瓶组装成一套微型装置(如图所示)来替代上图中的装置B,固体只需极少量、液体用量也很少(或只需1~它小滴),相对用装置B做实验的优点是______(填序号):
①节约药品用量②能完全消除废液排放
③能控制液体的滴加速度④产生的气体不含任何杂质
(6)设计图,除去氧气中混有的少量二氧化碳气体,并收集一瓶氧气,除杂时混合气体的气流方向是由______(填“a”或“b”)端进入洗气瓶.用该装置验证二氧化碳是否与水反应:提供的药品有:
①紫色石蕊溶液;②紫色石蕊试液染成的干燥纸花.
A、B中应依次盛放______(填药品序号).
[假设]小英的假设:澄清石灰水已变质;
小青的假设:气体X中除了有CO2外,还有其它气体.
[实验探究]
(1)小英的探究:
| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结论 |
| 探究所用澄清石灰水是否变质 | ①用一支试管另取少量原澄清石灰水;②取稀硫酸与碳酸钠反应制取CO2;③ 将产生的气体通入所用澄清石灰水中 将产生的气体通入所用澄清石灰水中 . |
步骤③中现象为:澄清石灰水变浑浊. | 步骤②中反应方程式为: H2SO4+Na2CO3=Na2SO4+H2O+ CO2↑ H2SO4+Na2CO3=Na2SO4+H2O+ ;CO2↑ 实验结论 所用澄清石灰水没有变质 所用澄清石灰水没有变质 . |
| 实验目的 | 实验步骤 | 实验现象 | 实验结论 |
| 探究气体X中是否含有其它气体. | 将气体X通入: 硝酸银溶液 硝酸银溶液 . |
有白色沉淀生成. | 实验结论:气体X中含有 氯化氢(或HCl) 氯化氢(或HCl) 气体. |
(3)同学们经过讨论发现,只用一组实验装置就可以同时完成上述两个假设的探究.请你从图中选择一组合理的装置

(4)在上述合理装置的第一支试管内应放入
(5)在探究中,小英用稀硫酸代替稀盐酸与碳酸钠反应制取CO2气体,就不会使制得的CO2气体中混有影响其检验的气体,小英的理由是
(1)用高锰酸钾制氧气时,用排水法收集到的氧气呈红色.原因是
(2)做细铁丝在氧气中燃烧的实验时,集气瓶底部破裂.原因是
(3)用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊.针对此现象,同学们提出了自己的想法和做法,请你帮助他们完成以下探究.
[假设]
小英的假设:澄清石灰水已变质
小青的假设:气体X中除了有CO2外,还有
[实验探究]
Ⅰ.小英的探究:
| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结沦 |
| 探究所用 澄清石灰 水是否变 质 |
①用一支试管另取少 量原澄清石灰水 ②取稀硫酸与碳酸钠 反应制取CO2 ③ 将产生的气体通入所用澄清石灰水中 |
步骤③中现象为: 石灰水变浑浊或未变浑浊 |
步骤②中反应方程式为: H2SO4+Na2CO3=Na2SO4+ H2O+CO2↑ 步骤③可能的反应方程式略 实验结论: 所用澄清石灰水没有变质 或所用澄清石灰水已变质 |
| 实验目的 | 实验步骤 | 实验现象 | 化.学方程式和实验结论 |
| 探究气体X 中是否含有 氯化氢或HCl 气体 |
将气体X通入硝酸银 溶液 |
硝酸银溶液变浑浊或未变浑浊 |
反应方程式为: HCl+AgNO3=AgCl↓+HNO3 实验结论:气体X中含有 氯化氢或HCl 气体 |
Ⅲ.同学们经过讨论发现,只用一组实验装置就可以同时完成上述两个假设的探究.请你从下图中选择一组合理的装置

Ⅳ.在上述合理装置的第二支试管内应放入
分析:从表面看氧化钠似乎是溶质,其实它具有与水化合的性质,因此这里就隐蔽着氧化钠和水化合生成氢氧化钠的反应。可见真正溶质是氢氧化钠,其质量要通过计算才能得出。
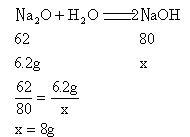 【解】设生成NaOH的质量为x
【解】设生成NaOH的质量为x
所得溶液中NaOH的质量分数为
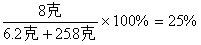 答案:(略)
答案:(略)
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)