网址:http://m.1010jiajiao.com/timu3_id_3004[举报]
[工艺流程示意图]
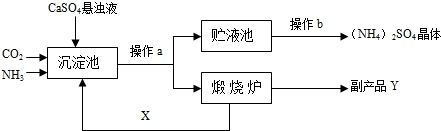
上述流程中,沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
[讨论交流]
(1)操作a的名称是
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
(3)图中操作b应怎样进行呢?
查阅资料:右图是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 溶解度/g | 70.6 | 73 | 75.4 | 78 | 81 | 85 | 88 | ? | 95 | 98 | 103 |
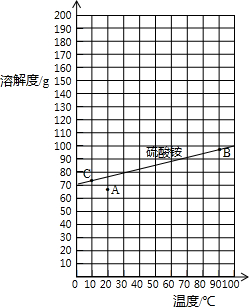
下列说法正确的有
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;②图中的A点表示硫酸铵溶液的状态不饱和;③若将A点变成B点的操作采用加热蒸发、使溶液浓缩的方法④若将B点转化为C点时,采用的是冷却热饱和溶液方法
该化肥厂生产的硫酸铵化肥品质怎样呢?
[查阅资料]下表是硫酸铵化肥品质的主要指标.
| 指标项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥20.7% | ≥20.5% |
已知:(NH4)2SO4+2NaOH
| ||
[观察外观]该硫酸铵化肥无可见机械杂质.
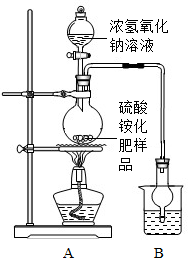
[实验探究]按如图所示装置进行实验.
(1)实验过程中,为使硫酸铵充分反应完全转化为NH3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)选择右图装置A进行实验的原因
[交流讨论]
甲同学认为:应在实验装置中A、B装置间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
乙同学认为:改进后的实验装置中还存在另一个明显缺陷是:
(经过大家充分讨论后,对实验装置进行了改进,重新进行实验.)
[探究结论]称取13.5 g硫酸铵化肥样品,用最终改进后的实验装置重新进行实验,经数据处理释放出氨气的质量与反应时间如图所示.试通过计算,判断该化肥的等级.
某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2.他们不禁产生了疑问:书本119页的实验中,CO与Fe2O3反应生成的黑色物质真的是Fe粉吗?于是他们进行了以下探究.
【查阅资料】
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有______,乙、丙实验现象说明黑色物质中没有______;
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式______;
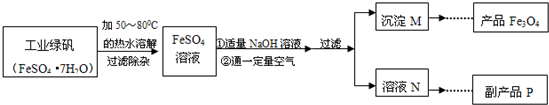
【拓展探究】同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
【生产流程】

【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
 Fe3O4+4H2O
Fe3O4+4H2O【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是______.
(2)写出加入适量NaOH溶液时发生反应的化学方程式______;
(3)上述过程中,要控制“通一定量空气”的目的是______.
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为______.
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→______→______→d.
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
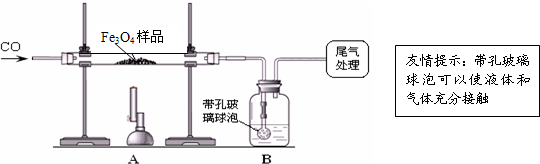
【实验设计】同学们称取了23.28g该Fe3O4样品进行了下列实验:

【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是_______(填序号).
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③______.
(3)乙组同学认为B装置反应前后的
 质量差会偏小而影响计算、分析,你认为他们的理由是______.
质量差会偏小而影响计算、分析,你认为他们的理由是______.乙组:
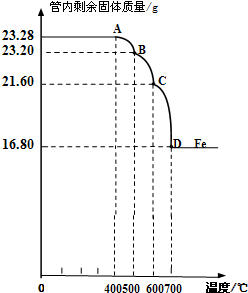
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:______.
(2)通过计算确定:该Fe3O4样品中含有的杂质是______,其中含Fe3O4的质量是______g.(不需要写过程) 查看习题详情和答案>>
【查阅资料】
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
【拓展探究】同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
【生产流程】
【查阅资料】
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
【问题讨论】
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
【组成确定】为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
【查阅资料】
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
【提出猜想】Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
【实验设计】同学们称取了23.28g该Fe3O4样品进行了下列实验:
【实验分析】因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.B中的最佳试剂是_
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,还能起到的作用是:①实验开始时,排尽装置中的空气,防止加热时发生爆炸;②停止加热后,防止A中生成物被氧化,B中的溶液倒吸入A中;③
(3)乙组同学认为B装置反应前后的
 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(右图).
(1)写出BC段发生反应的化学方程式:
| ||
| ||
(2)通过计算确定:该Fe3O4样品中含有的杂质是
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
查看习题详情和答案>>
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
查看习题详情和答案>>