摘要:25. 大多金属碳化物能与水剧烈反应(非氧化还原反应).生成相应氢氧化物和气态烃.如: Na4C+4H2O = 4NaOH + CH4↑, MgC2 + 2H2O = Mg(OH)2 + C2H2↑ 现有CaC2与某常见金属碳化物A的混合物.与足量盐酸反应.得一澄清溶液.并有大量气体产生.将气体通过碱石灰干燥除杂后.测其体积为V1.将所得气体充分燃烧.生成的CO2的体积为V2.相同条件下.V1∶V2 = 5∶7,向澄清溶液中逐渐加入足量Na2CO3溶液.沉淀的物质的量变化如图1所示.继续加入NaOH溶液.沉淀物质的量变化如图2所示.试回答下列问题: (1) A中的金属元素是: .CaC2与浓盐酸反应的化学方程式: , (2) 根据V1∶V2 = 5∶7.可算出混合烃中平均每1mol烃分子含有 mol C.由此可知气态混合烃中含有乙炔和 , (3) A的化学式为 , (4) 原混合物中CaC2的物质的量为 mol, A的质量为 g. (命题人:李尔康 审题人:吴丹丹) 西南师大附中2009-2010学年度上期期末考试
网址:http://m.1010jiajiao.com/timu3_id_298914[举报]
大多金属碳化物能与水剧烈反应,生成相应氢氧化物和气态烃,如:
Na4C+4H2O→4NaOH+CH4↑, MgC2+2H2O→Mg(OH)2+C2H2↑
现有CaC2与某常见金属碳化物A的混合物,与足量盐酸反应,得一澄清溶液,并有大量气体产生,将气体通过碱石灰干燥除杂后,测其体积为V1,将所得气体充分燃烧,生成的CO2的体积为V2,相同条件下,V1:V2=5:7:向澄清溶液中逐渐加入足量Na2CO3溶液后,再继续加入NaOH溶液,沉淀物质的量变化如下图所示,试回答下列问题:
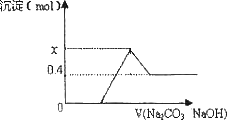
(1)已知A中的金属元素是短周期元素,则该元素是:________(写元素符号),写出CaC2与浓盐酸反应的化学方程式:________;
(2)根据Vl∶V2=5∶7,可算出混合烃中平均每Imol烃分子含有________molC,由此可知气态混合烃中含有乙炔和________,
(3)A的化学式为________;
(4)原混合物中CaC2的物质的量为________mol,A的质量为________g.