摘要:12.如右图所示将2mol SO2和1mol O2混合置于体积可变的等压容器中.在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH<0.该反应达到平衡状态A时.测得气体总物质的量为2.4mol.若SO2.O2.SO3的起始物质的量分别用a.b.c 表示.回答下列问题: ⑴达平衡状态A时n(SO3)= .若在达到平衡状态A的容器中再通入少 量O2.体系中SO2的体积分数 (填“增大 或“减小 或“不变 ). ⑵ 若起始时a=1.2mol.b=0.6mol.且达到平衡后各气体的体积分数与平衡状态A相同. 则起始时c的取值为 . ⑶ 若要使反应开始时向逆反应方向进行.且达到平衡后各气体的物质的量与平衡状态 A相同.则起始时c的取值范围是 .
网址:http://m.1010jiajiao.com/timu3_id_297802[举报]
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.

(1)利用反应6NO2+8NH3
7N2+12H2O可以处理NO2.当转移1.2mol电子时,生成的N2在标准状况下是
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1 2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H
(4)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.请回答:
①通入O2的电极名称是
②通入CH3OH的电极的电极反应式是
查看习题详情和答案>>

(1)利用反应6NO2+8NH3
| 催化剂 | △ |
7.84
7.84
L.(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1 2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=
-41.8
-41.8
kJ?mol-1.一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b
b
.a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
2.67
2.67
.(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H
<
<
0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已较高,若再增大压强,CO的转化率提高不大,且生产成本增加,得不偿失
在1.3×104kPa下,CO的转化率已较高,若再增大压强,CO的转化率提高不大,且生产成本增加,得不偿失
.(4)某实验小组依据甲醇燃烧的反应原理,设计如图2所示的装置.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.请回答:
①通入O2的电极名称是
正
正
,B电极的名称是阳
阳
.②通入CH3OH的电极的电极反应式是
CH3OH+8OH-+6e-=CO32-+6H2O
CH3OH+8OH-+6e-=CO32-+6H2O
,A电极的电极反应式为Ag++e-=Ag
Ag++e-=Ag
.研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)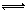 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。(2)已知:2SO2(g)+O2(g)
 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-12NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
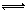 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)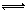 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3
 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。(2)已知:2SO2(g)+O2(g)
 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-12NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
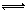 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。 