网址:http://m.1010jiajiao.com/timu3_id_296873[举报]
B.高温时Na2CO3+SiO2=Na2SiO3+CO2↑
C.高温时CaCO3+SiO2=CaSiO3+CO2↑
D.高温时Na2CO3+6SiO2+CaCO3=Na2O+CaO+6SiO2+2CO2↑
生产普通玻璃时,可能发生主要的化学反应是
A.高温时Na2+SiO2=Na2SiO3
B.高温时Na2CO3+SiO2=Na2SiO3+CO2↑
C.高温时CaCO3+SiO2=CaSiO3+CO2↑
D.高温时Na2CO3+6SiO2+CaCO3=Na2O+CaO+6SiO2+2CO2↑
查看习题详情和答案>>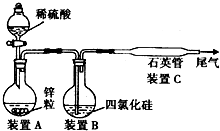 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅:SiO2+2C
| ||
②粗硅与干燥的Cl2反应制得SiCl4:Si+2C12
| ||
③SiCl4被过量的H2在1 000~1 100℃时还原制得纯硅:SiCl4+2H2
| ||
某同学从资料中查知:SiCl4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl4从装置B中逸出与H2充分混合,应采取的措施是
(2)装置C不能采用普通玻璃管的原因是
(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是
(4)为防止空气污染,含有SiCl4的尾气要通入盛有
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是
有机合成粘合剂是生产和生活中一类重要的材料,粘合的过程一般是呈液态的粘合剂小分子,经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其成分为![]() -氰基丙烯酸乙酯(CH2=C(CN)COOCH2CH3),当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可将被粘物牢牢粘在一起。请写出“502胶”发生粘合作用的化学方程式。
-氰基丙烯酸乙酯(CH2=C(CN)COOCH2CH3),当暴露在空气中时,微量的水起催化作用,使其发生碳碳双键的加聚反应而迅速固化,几秒钟即可将被粘物牢牢粘在一起。请写出“502胶”发生粘合作用的化学方程式。
(2)厌氧胶(主要成分为CH2=CHCOOCH2CH2OOCCH=CH2)是另一种粘合剂,它与“502胶”不同,可在空气中长期储存,但在隔绝空气(缺氧)时,分子中的双键断开发生聚合而固化。在工业上用丙烯酸和某物质在一定条件下反应可制得这种粘合剂。则这一制取过程的化学反应的方程式为____________________________________________。
(3)白乳胶发生粘合过程的化学机理与上述两种粘合剂相似,其主要成分为醋酸乙烯酯(CH3COOCH=CH2)。醋酸乙烯酯含有-CH=CH-结构的同分异构体很多,但含有![]() 结构的物质不能稳定存在。除下列物质外CH2=CHCOOCH3、HCOOCH=CH-CH3、HCOCH(OH)CH=CH2、HCOOCH=CH-CH3。
结构的物质不能稳定存在。除下列物质外CH2=CHCOOCH3、HCOOCH=CH-CH3、HCOCH(OH)CH=CH2、HCOOCH=CH-CH3。
请写出另外符合上述要求、并且属于酯类物质的同分异构体的结构简式(任写四种):
_____________________________________________________________________。
(4)已知:2CH3OH+HCHO![]() CH3OCH2OCH3+H2O反应可以发生。聚乙烯醇(
CH3OCH2OCH3+H2O反应可以发生。聚乙烯醇(![]() )也是一种粘合剂,其水溶液可做普通胶水使用。它分子中的羟基可全部与丁醛缩合脱水,得到含有六元环的高分子化合物----聚乙烯醇缩丁醛,其粘合能力远比聚乙烯醇强,广泛应用于防弹玻璃、飞机舱玻璃的胶接。请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:______________________________________________。
)也是一种粘合剂,其水溶液可做普通胶水使用。它分子中的羟基可全部与丁醛缩合脱水,得到含有六元环的高分子化合物----聚乙烯醇缩丁醛,其粘合能力远比聚乙烯醇强,广泛应用于防弹玻璃、飞机舱玻璃的胶接。请写出制取聚乙烯醇缩丁醛粘合剂的化学方程式:______________________________________________。
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
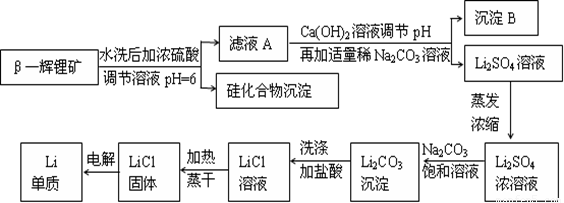
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
查看习题详情和答案>>