摘要:(四)比较外因盐水解的影响. A-+H2O HA+OH- 温度(T)T↑ 平衡 移. 水解程度 加水 平衡 移. 水解程度 . 增大[H+] 平衡 移. 水解程度 增大[OH-] 平衡 移. 水解程度 . 增大[A-] 平衡 移. 水解程度 思考:①弱酸的电离和弱酸根离子的水解互为可逆吗? ②在CH3COOH和CH3COONO2的溶液中分别加入少量冰醋酸.对CH3COOH电离程度 和CH3COO-水解程度各有何影响?
网址:http://m.1010jiajiao.com/timu3_id_294537[举报]
(15分)在铜的催化作用下氨和氟反应得到一种铵盐和一种三角锥体分子A(键角102o,偶极矩0.78x10-30 C?m;对比:氨的键角107.3o,偶极矩4.74x10-30 C?m);
4-1 写出A的分子式和它的合成反应的化学方程式。
4-2 A分子质子化放出的热明显小于氨分子质子化放出的热。为什么?
4-3 A与汞共热,得到一种汞盐和一对互为异构体的B和C(相对分子质量66)。写出化学方程式及B和C的立体结构。4-4 B与四氟化锡反应首先得到平面构型的D和负二价单中心阴离子E构成的离子化合物;这种离子化合物受热放出C,同时得到D和负一价单中心阴离子F构成的离子化合物。画出D、E、F的立体结构;写出得到它们的化学方程式。
4-5 A与F2、BF3反应得到一种四氟硼酸盐,它的阳离子水解能定量地生成A和HF,而同时得到的O2和H2O2的量却因反应条件不同而不同。写出这个阳离子的化学式和它的合成反应的化学方程式,并用化学方程式和必要的推断对它的水解反应产物作出解释。 查看习题详情和答案>>有A、B、C、D四种可溶性盐,它们分别是AgNO3、CuSO4、Na2CO3、BaCl2中的一种,现进行如下实验:
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色.②若向①的四支试管中分别加盐酸,B的溶液有沉淀产生,D的溶液有无色无味的气体逸出.根据①、②实验事实,回答下列问题:
(1)写出下列物质的化学式:
A.
(2)写出实验②中有关反应的离子方程式:
查看习题详情和答案>>
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色.②若向①的四支试管中分别加盐酸,B的溶液有沉淀产生,D的溶液有无色无味的气体逸出.根据①、②实验事实,回答下列问题:
(1)写出下列物质的化学式:
A.
BaCl2
BaCl2
B.AgNO3
AgNO3
C.CuSO4
CuSO4
D.Na2CO3
Na2CO3
(2)写出实验②中有关反应的离子方程式:
Ag++C1-=AgCl↓
Ag++C1-=AgCl↓
;CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
.A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-的某一种.
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出.根据(1)、(2)实验事实可推断它们的化学式为:A.
查看习题详情和答案>>
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出.根据(1)、(2)实验事实可推断它们的化学式为:A.
BaCl2
BaCl2
BAgNO3
AgNO3
CCuSO4
CuSO4
DNa2CO3
Na2CO3
.A、B、C、D四种可溶性盐,它们的阳离子可能分别是Ca2+、Ag+、K+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种.
(1)若把4种盐分别溶解于盛有蒸馏水的4支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的4支试管中分别加盐酸,B溶液中有沉淀产生,D溶液中有无色无味气体逸出.根据(1)(2)的实验事实推断4种盐的化学式为:
A
查看习题详情和答案>>
(1)若把4种盐分别溶解于盛有蒸馏水的4支试管中,只有C盐的溶液呈蓝色.
(2)若向(1)的4支试管中分别加盐酸,B溶液中有沉淀产生,D溶液中有无色无味气体逸出.根据(1)(2)的实验事实推断4种盐的化学式为:
A
CaCl2
CaCl2
,BAgNO3
AgNO3
,CCuSO4
CuSO4
,DK2CO3
K2CO3
.(2010?四川)四川攀枝花蕴藏丰富的钒、钛、铁资源.用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如图:
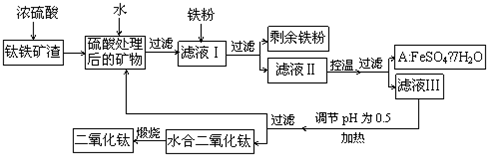
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为:
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解.水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀.请用所学化学平衡原理分析通入高温水蒸气的作用:
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556akgA(摩尔质量为278g/mol)溶于水中,加入过量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体,再向红褐色胶体中加入3336bkgA和112ckg铁粉,鼓入足量空气搅拌,反应完全后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料,若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
查看习题详情和答案>>

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是
TiO2+2H2SO4=Ti2(SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O
TiO2+2H2SO4=Ti2(SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O
.(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为:
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
、Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解.水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀.请用所学化学平衡原理分析通入高温水蒸气的作用:
加入促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解
加入促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解
.过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、H2O
H2O
、FeSO4
FeSO4
、H2SO4
H2SO4
(填化学式),减少废物排放.(4)A可用于生产红色颜料(Fe2O3),其方法是:将556akgA(摩尔质量为278g/mol)溶于水中,加入过量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体,再向红褐色胶体中加入3336bkgA和112ckg铁粉,鼓入足量空气搅拌,反应完全后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料,若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料
160a+320b+160c
160a+320b+160c
kg.