网址:http://m.1010jiajiao.com/timu3_id_292382[举报]
能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
(1)为减少污染,提高燃料利用率,下列措施可以达到目的是
A.城市居民不用天然气而烧煤,烧木柴
B.若将原来烧天然气的灶具改烧液化石油气(成份为C3H8、C4H10),应增大空气进入量或减少液化气的进入量
C.研制燃料电池
D.在农村大力发展沼气
(2)关于用水制取二级能源氢气,以下研究方向不正确的是
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
(3)lg 氢气燃烧时约放热142.9KJ,而1kg汽油燃烧时放热46000KJ.氢气被分认是21世纪替代矿物燃料的理想能源.你认为氢气作为能源的两个主要优点:
 置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):
置换反应的通式可表示为(转化中涉及的均为中学化学的常见物质):请回答下列问题:
(1)若单质甲与化合物A发生的反应常用于野外焊接钢轨,则该反应的化学方程式为
| ||
| ||
(2)若甲、乙分别是同主族的两种非金属固体单质,则化合物A的一种主要用途是
(3)若甲、乙分别是同主族短周期元素的两种单质,化合物B是一种强碱,则反应的离子方程式为
(4)若组成单质乙的元素的最外层电子数是次外层电子数的2倍,金属单质甲能在化合物A中燃烧,则该反应中氧化剂与还原剂的物质的量之比为
(1)请写出炉气制造即沸腾炉中黄铁矿燃烧的化学方程式
| ||
| ||
 (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.A、精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图1所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是
B、接触室中2SO2(g)+O2(g)
| ||
| △ |
已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:

①图中C点表示
②反应达到平衡时,平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
(3)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物.取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收.实验数据如下:
| 实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
| 第一次 | 1.570 | 0.340 |
| 第二次 | 3.140 | 0.680 |
| 第三次 | 4.710 | 0.510 |
| 第四次 | 6.280 | 0 |
②x的值为
(12分)钛(Ti)被誉为“21世纪的金属”。工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg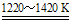 Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为_____________________。
(2)与CO互为等电子体的分子是___________。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______化合物(填“离子”或“共价”)。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_____________________________________。
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是____________ (填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为 ,中心离子配位数为 。
( 15 分)
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式是:
________________________________________________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:
________________________________________________。
(3)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池。该电池中负极上的电极反应式是:______________________________________________________。
(4)制备二甲醚的合成气可由甲烷与水燕气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下: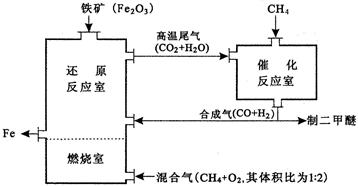
①在催化反应室中进行的反应均为可逆反应.增大体系的压强对甲烷转化率的影响是___________________________(填“增大”、“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5 y kg(y/11.2×103mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进人催化反应室,则这些高温尾气在理论上可产生合成气_______________m3(标准状况)。