摘要:化合价的规律有哪些? 剖析:(1)在化合物里.氧通常显-2价(因为氧原子最外层有6个电子.易得到 2个电子或使电子对偏向).氢通常显+1价(因为氢原子外层只有1个电子.易失去或使电子对偏离).金属元素通常显正价(因为其原子的最外层电子数较少.易失去电子).非金属元素通常显负价(因为其原子的最外层电子数较多.易得到电子或使电子对偏向).但在非金属氧化物里.氧显负价.另一种非金属元素显正价(因为氧原子得电子能力很强). (2)在化合物里.正.负化合价的代数和为零. (3)在单质中元素的化合价为零. (4)有些元素的化合价是可变的.可变的原因是这些元素的原子在不同条件下.既可得电子.也可失电子.而且得失电子数目可以不同. (5)某些原子团也表现出一定的化合价. 问题探究 问题 举例说明如何计算化合物中某元素的质量分数? 探究:此类题目计算时.应注意解题格式要规范.“100% 不能丢掉.原子个数要统计准确. 某元素的质量分数=×100% 例如:计算NH4NO3中氮元素的质量分数. ×100% ×100%=35% 典题精讲 例1 判断下列化学符号中数字“2 的意义.将其序号填在相应的横线上:①Ca2+ ②NO2 ③2NO?④? ⑤2 (1)表示分子个数的是 . (2)表示一个离子所带电荷数的是 . (3)表示元素化合价的是 . (4)表示一个分子中所含原子个数的是 . 思路解析:Ca2+中的“2 表示一个钙离子带两个单位正电荷,NO2中的“2 表示一个NO2分子中含有2个氧原子,2NO中的“2 表示分子个数,中的“2 表示MgO中Mg元素化合价为+2,2中的“2 表示离子的个数. 答案:④ (4)② 例2下列物质含氮量最高的是( ) A.NH4HCO3 B.(NH4)2SO4 C.NH4NO3 D.NaNO3 思路解析:此题有一个巧解法:比较不同物质中含同一元素质量分数的大小时.可以换算成该元素的同一组成的含量.然后比较剩余组成的相对分子质量.根据剩余组成相对分子质量由小到大的顺序.就是对应质量分数由大到小的顺序. 在NH4HCO3中.其余相对式量是H5CO3=65,在(NH4)2SO4中.其余相对式量是H8SO4/2=52,在NH4NO3中.其余相对式量是H4O3/2=26,在NaNO3中.其余相对式量是71.硝酸铵含氮量最高. 答案:C 知识导学 任何纯净物都有固定的组成.一种物质只能有一个化学式. 关于化学式所表达的信息一定要理解.这对后面的有关化学式的正确计算有着重要意义. 书写化学式的记忆口诀: 正价前.负价后,金属左. 非金右.氧化物中氧在后. ①原子团的个数是1时.1省略不写.不需要加括号,如果原子团的个数是2或3时.把原子团加括号.在括号的右下角标上数字. ②+2价的铁称亚铁. ③绝不能根据化合价随意乱造事实上不存在的物质的化学式. 一般说来.有的单质是由原子构成的.由原子构成的单质.它们的化学式直接用元素符号直接去表示. 有的单质由分子构成.它们的化学式:先写出元素符号.在元素符号的右下角加上数字“2 . 学习化合价的方法: 对于化合价的概念.不需要理解多深.只要能记住会用.会根据化合物中化合价的代数和等于零的原则书写化学式即可. 为了能够熟练.快速.准确地书写化学式.要记住常见元素或原子团的化合价.计算元素的化合价首先要记住常见元素的化合价.其次要了解化合价遵守的法则.即在一切化合物里.正.负化合价的代数和一定为零.以不变应万变. 记忆化合价的口诀: 一价钾钠氢氯银.二价钙镁钡锌氧 三价铝四价硅.二三铁.二四碳 二四六硫都齐全.铜汞二价最常见 常见原子团的化合价: 负一硝酸氢氧根.负二硫酸碳酸根.正一价的是铵根. 原子团:在化学反应中并不是所有的时候都是作为一个整体参加反应,原子团不能单独存在.必须与其他的原子或原子团结合才能成为物质的化学式. 化合价只有在元素之间形成化合物时才能表现出来.当元素以单质的形式存在时.其化合价定为零. 疑难导析 化学式表示的意义可从宏观和微观两个方面进行论述:宏观上表示什么.微观上表示什么. 化学式表示的意义还可以从量的方面进行论述:如是否表示分子中的原子数.是否表示分子中各原子的个数比等. 化合价的规律要从以下几方面论述: 一是要说明在化合物里.氧.氢通常的化合价及氧原子的电子层结构.电子的得失及电子对的偏向趋势,金属元素通常的化合价及金属原子的电子层结构.电子的得失,非金属元素通常的化合价及原子的电子层结构.电子的得失及电子对的偏向趋势,非金属氧化物里.氧的化合价,另一种非金属元素的化合价. 二是在化合物里.正.负化合价的关系. 三是在单质中元素的化合价. 四是有些元素的化合价的可变性及其原因. 五是某些原子团的化合价及其计算方法. 问题导思 在计算质量分数时.一定把所求元素的原子个数找清楚.不要漏掉.如例题中每个硝酸铵分子中含有2个氮原子.因此计算氮的质量分数时一定要注意用氮的相对原子质量乘以2. 有时在进行此类题的计算时.通常先计算物质中某元素的质量.一定量的某物质中所含某元素的质量与该物质的质量.该元素在化合物中的质量分数之间的关系. 典题导考 绿色通道 明确化学符号周围各数字的含义:化学符号前的数字表示粒子的个数,右下角表示每个粒子中所含有该原子的数目,右上角表示离子所带的电荷数,正上方表示这种元素在化合物中表现出来的化合价. 典题变式 写出下列数字“2 的意义: (1)2H: . (2)H2: . (3)2H2O: . 答案:每个氢分子含两个氢原子,(3)前面的“2 表示两个水分子.右下角的“2 表示每个水分子含有两个氢原子. 绿色通道 常规解法是根据元素的质量分数=化合物中某元素的相对原子质量×该元素的原子个数/化合物的相对分子质量×100%. 典题变式 在铁的三种氧化物FeO.Fe2O3.Fe3O4中.铁元素的质量分数由大到小的排列顺序为( ) A.FeO>Fe2O3>Fe3O4 B.Fe2O3>Fe3O4>FeO C.Fe3O4>Fe2O3>FeO D.FeO>Fe3O4>Fe2O3 答案:D
网址:http://m.1010jiajiao.com/timu3_id_29171[举报]
对于大量的实验事实进行分析,能够找出一些规律,根据这些规律,可以对一些物质的性质作出推测,这是学习化学及进行科学研究的重要方法.已知氟(F)、氯(Cl)、溴(Br)、碘(I)四种元素的原子在结构上有一些相似之处,化学上把它们通称为卤族元素,卤族元素的单质具有相似的组成、结构和化学性质.其单质的物理性质随着原子序数的递增呈现规律性的变化.请你利用上述信息和下表中给出的卤族元素单质的一些性质,推测出表中有关卤族元素单质的组成和性质,填写表中空格,并回答表后问题.
请把表格填完整.分析表格,可以总结出的规律有哪些?
查看习题详情和答案>>
| 卤族元素的名称 | 氟 | 氯 | 溴 | 碘 |
| 原子序数 | 9 | 17 | 35 | 53 |
| 通常状况下的状态 | 气体 | 液体 | 固体 | |
| 单质的颜色 | 淡黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 |
| 单质的熔点(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 单质的沸点(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
对于大量的实验事实进行分析,能够找出一些规律,根据这些规律,可以对一些物质的性质作出推测,这是学习化学及进行科学研究的重要方法.已知氟(F)、氯(Cl)、溴(Br)、碘(I)四种元素的原子在结构上有一些相似之处,化学上把它们通称为卤族元素,卤族元素的单质具有相似的组成、结构和化学性质.其单质的物理性质随着原子序数的递增呈现规律性的变化.请你利用上述信息和下表中给出的卤族元素单质的一些性质,推测出表中有关卤族元素单质的组成和性质,填写表中空格,并回答表后问题.
| 卤族元素的名称 | 氟 | 氯 | 溴 | 碘 |
| 原子序数 | 9 | 17 | 35 | 53 |
| 通常状况下的状态 | 气体 | 液体 | 固体 | |
| 单质的颜色 | 淡黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 |
| 单质的熔点(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 单质的沸点(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
对于大量的实验事实进行分析,能够找出一些规律,根据这些规律,可以对一些物质的性质作出推测,这是学习化学及进行科学研究的重要方法.已知氟(F)、氯(Cl)、溴(Br)、碘(I)四种元素的原子在结构上有一些相似之处,化学上把它们通称为卤族元素,卤族元素的单质具有相似的组成、结构和化学性质.其单质的物理性质随着原子序数的递增呈现规律性的变化.请你利用上述信息和下表中给出的卤族元素单质的一些性质,推测出表中有关卤族元素单质的组成和性质,填写表中空格,并回答表后问题.
请把表格填完整.分析表格,可以总结出的规律有哪些?
查看习题详情和答案>>
| 卤族元素的名称 | 氟 | 氯 | 溴 | 碘 |
| 原子序数 | 9 | 17 | 35 | 53 |
| 通常状况下的状态 | 气体 | 液体 | 固体 | |
| 单质的颜色 | 淡黄绿色 | 黄绿色 | 深红棕色 | 紫黑色 |
| 单质的熔点(℃) | -219.6 | -101 | -7.2 | 113.5 |
| 单质的沸点(℃) | -188.1 | -34.6 | 58.78 | 184.4 |
查看习题详情和答案>>
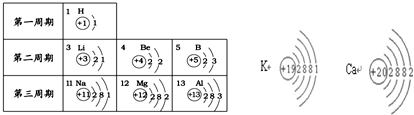
元素周期表是学习化学的重要工具,依据下表回答问题:

(1)表中13号元素的名称为
(2)从每一纵行分析,我发现的规律有
(3)K、Ca、Mg三种金属单质的失电子能力逐渐减弱,请根据这三种金属元素的原子结构推测:金属单质失电子能力的强弱主要与哪些因素有关?
查看习题详情和答案>>
| 第一周期 | 1 H |
||
| 第二周期 | 3 Li |
4 Be |
5 B |
| 第三周期 | 11 Na |
12 Mg |
13 Al |

(1)表中13号元素的名称为
铝
铝
,属于金属
金属
(填“金属”或“非金属”)元素,在化学反应中易失
失
电子,变成Al3+
Al3+
(填符号).(2)从每一纵行分析,我发现的规律有
每一纵行最外层电子数相同(合理即可)
每一纵行最外层电子数相同(合理即可)
.(3)K、Ca、Mg三种金属单质的失电子能力逐渐减弱,请根据这三种金属元素的原子结构推测:金属单质失电子能力的强弱主要与哪些因素有关?
最外层电子数(或电子层数)
最外层电子数(或电子层数)
.