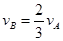摘要:16.对于某反应x在甲.乙.丙.丁四种不同条件下.分别测得反应速率为甲:,乙:,丙:,丁:.则反应最快的是 A.甲 B.乙 C.丙 D.丁
网址:http://m.1010jiajiao.com/timu3_id_289965[举报]
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
(1)汽油在不同
比(空气与燃油气的体积比)时尾气的主要成分不同,
比较小时的有毒气体主要是
(2)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1.
查阅资料获知如下反应的热化学方程式:
N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
①一定条件下,N2与O2反应生成NO或NO2均能够自发进行,其原因是
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=
(3)目前科学家设想将排放到空气中CO2转化为有机物来有效实现碳循环,如:
A.6CO2+6H2O
C6H12O6+6O2 B.CO2+3H2
CH3OH+H2O
C.CO2+CH4
CH3COOH D.2CO2+6H2
CH3OCH3+3H2O
以上反应中原子利用率最高的是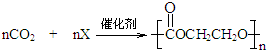 ,则X的结构简式为
,则X的结构简式为
 .
.
查看习题详情和答案>>
(1)汽油在不同
| 空 |
| 燃 |
| 空 |
| 燃 |
CO
CO
(填化学式).(2)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
已知:N2、O2分子中化学键的键能分别是946kJ?mol-1、497kJ?mol-1.
查阅资料获知如下反应的热化学方程式:
N2(g)+O2(g)=2NO(g)△H=+180kJ?mol-1
N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
①一定条件下,N2与O2反应生成NO或NO2均能够自发进行,其原因是
△S>0
△S>0
;NO分子中化学键的键能为631.5
631.5
kJ?mol-1.②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=
-1200kJ?mol-1
-1200kJ?mol-1
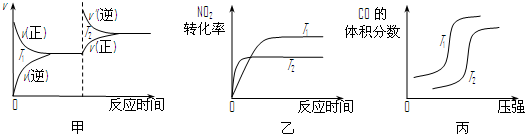
.对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙
乙
(填代号).
(3)目前科学家设想将排放到空气中CO2转化为有机物来有效实现碳循环,如:
A.6CO2+6H2O
| 光合作用 |
| ||
| △ |
C.CO2+CH4
| ||
| △ |
| ||
| △ |
以上反应中原子利用率最高的是
C
C
,最节能的是A
A
.某物质X的核磁共振氢谱只有一个峰,可与CO2发生加聚反应生成可降解塑料,反应如下: ,则X的结构简式为
,则X的结构简式为

对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为vx,(x代表某反应物或生成物)之间的关系,正确的是( )
A、vA=
| ||
B、vB=
| ||
C、vB=
| ||
D、vB=
|
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol
,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol
,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________ (填字母)。[来源:学*科*网Z*X*X*K]
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
查看习题详情和答案>>
 ,(x代表某反应物或生成物)之间的关系,正确的是( )
,(x代表某反应物或生成物)之间的关系,正确的是( )