摘要:3.(湖南市长沙一中2009届高三第三次模拟考试天然维生素P(结构如下图.分子结构中R为饱和烃基)存在于槐树花蕾中.它是一种营养增补剂.关于维生素P的叙述不正确的是( ) A.可与溴水反应.且1 mol该物质与足量溴水反应消耗5 mol Br2 B.可与NaOH溶液反应.1 mol该物质可与4 mol NaOH反应 C.一定条件下1 mol该物质可与H2加成.耗H2最大量为8mol D.维生素P遇FeCl3溶液发生显色反应
网址:http://m.1010jiajiao.com/timu3_id_289265[举报]
某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题.
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
(1)步骤①中中还需补充的仪器有
(2)步骤③中你选择的酸碱指示剂是
(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是
(4)样品总酸量=
查看习题详情和答案>>
实验目的
实验目的
测定食醋的总酸量实验原理
实验原理
中和滴定实验用品
实验用品
蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g/100mL),0.1000mol/LNaOH标准溶液;100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊).实验步骤
实验步骤
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
数据记录
数据记录
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
问题与思考
问题与思考
(1)步骤①中中还需补充的仪器有
洗耳球、玻璃棒、胶头滴管
洗耳球、玻璃棒、胶头滴管
.蒸馏水的处理方法是蒸馏水煮沸除去CO2并迅速冷
蒸馏水煮沸除去CO2并迅速冷
.(2)步骤③中你选择的酸碱指示剂是
酚酞
酚酞
,理由是食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂
食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂
.(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是
用活性炭脱色
用活性炭脱色
.(4)样品总酸量=
4.50
4.50
g/100mL.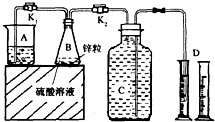 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
香花石有“国宝”之称,系1958年由中国学者在湖南香花岭锡矿发现的矿物晶体.组成香花石的元素为周期表中前20号主族元素,化学式为X3Y2(ZWR4)3T2.已知X、Y、Z为金属元素,Z原子最外层电子数与次外层电子数相等,X、Z位于同主族,Y、Z、R、T位于同周期,R原子最外层电子数为其次外层电子数的3倍,T元素无正价,X、R元素的原子序数之和是W的2倍.下列说法中不正确的是( )
| A、原子半径:X>Z>R>T | B、气态氢化物的稳定性:T>R>W | C、最高价氧化物对应水化物的碱性:Z<Y<X | D、化合物XR2和WR2中R元素的化合价相同 |
(2009?黄浦区二模)(2010?长沙模拟)20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性.下图所示为n个C60连接而成的物质X.下列有关说法不正确的是( )

查看习题详情和答案>>
 某学习小组为测定市售过氧化钠纯度,设计了如下方案:
某学习小组为测定市售过氧化钠纯度,设计了如下方案:实验原理:2Na2O2+2H2O═4NaOH+O2↑(杂质不参与反应)
仪器装置:如图.
实验步骤:
①称取过氧化钠样品2.00g;
②把过氧化钠样品放入气密性良好的气体发生装置锥形瓶中(固体体积忽略不计);
③向过氧化钠样品中滴加水,用量气装置测得气体体积为166.00mL(已换算成标准状况);
④锥形瓶中液体体积为54.00mL;
⑤将锥形瓶内液体全部转移入仪器A中,并定容至250.00mL;
请回答下列问题:
(1)仪器A的名称:
(2)生成气体的体积为
(3)据报导,该反应还会有副反应:Na2O2+2H2O═2NaOH+H202,H2O2生成,会使测定结果
(4)为效正实验结果.该小组补做了如下实验:用滴定管量取20.00mL.A中的液体放入锥形瓶中,用0.010mol/L.的H2SO4酸化的高锰酸钾溶液滴定至终点,用去12.00ml.高锰酸钾溶液.其反应为:(未配平)KMnO4+H2O2+H2SO4→K2SO4+MnSO4+O2+H2O
①滴定时高锰酸钾溶液应装在
②此实验未使用指示剂,如何确定终点:
③由上述实验测定数据,计算该过氧化钠样品纯度(写出计算过程). 查看习题详情和答案>>