摘要: 减小15. (1)2.2×10-8g (2)6.25×10-17mol•L-1 参考答案十六1-------10 BBBCDCBCAA
网址:http://m.1010jiajiao.com/timu3_id_288536[举报]
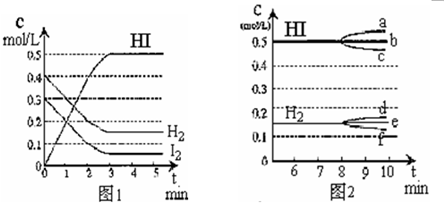
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0.反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为
(2)根据图1数据,反应达到平衡时,平均速率v(HI)为
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K
②若加入I2,H2浓度的变化正确的是
查看习题详情和答案>>
(1)该反应的化学平衡常数表达式为
K=
| c2(HI) |
| c(H2)c(I2) |
K=
;| c2(HI) |
| c(H2)c(I2) |
(2)根据图1数据,反应达到平衡时,平均速率v(HI)为
0.167mol
0.167mol
mol?L-1?min-1;(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K
减小
减小
(填写增大.减小或不变),HI浓度的变化正确c
c
;(用图2中a~c的编号回答)②若加入I2,H2浓度的变化正确的是
f
f
.(用图2中d~f的编号回答)
 在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了
在密闭容器中进行如下反应:mA(g)+nB(g)?pC(g),反应经5min达到平衡,测得此时A的浓度减小了a mol?L-1,而C的浓度增加了| 2 |
| 3 |
(1)写出上述反应的化学方程式
3A(g)+B(g)?2C(g)
3A(g)+B(g)?2C(g)
.(2)压强一定时,C的百分含量(C%)与温度、时间(T表示温度,t表示时间)的关系如图所示.由此可知,该反应为
放热
放热
(填“吸热”或“放热”)反应.(3)该反应的平衡常数表示式为
| c2(C) |
| c3(A)?c(B) |
| c2(C) |
| c3(A)?c(B) |
减小
减小
(填“增大”、“减小”或“不变”).二氧化碳碳捕获与封存技术(CCS)可以减少化石燃料燃烧以及其他工业用途的二氧化碳排放量,从而有助于减少温室气体的排放.该技术引起了各国的普遍重视.
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
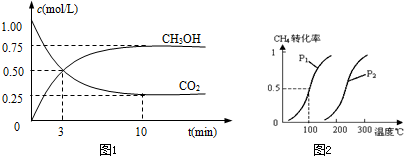
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
(2)反应①的△H1
,压强为P1,100℃时的平衡常数值是
查看习题详情和答案>>
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).②下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
增大
增大
(填“增大”、“减小”或“不变”),平衡向逆反应
逆反应
方向移动.(2)反应①的△H1
>
>
0(填“<”、“=”或“>”),其平衡常数表达式为K=| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
1.35×10-3
1.35×10-3
.(2010?宣武区二模)为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想.即先把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
(1)写出分解池中反应的化学方程式
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放热4947kJ,写出合成塔中反应的热化学方程式
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式
当电子转移为
(4)在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应.有关物质的浓度随时间变化如图所示.
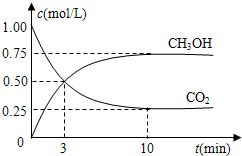
①从反应开始到平衡,H2的平均反应速率v(H2)=
②若其它条件不变,只将温度提高到800℃,再次达平衡时,
比值
查看习题详情和答案>>

(1)写出分解池中反应的化学方程式
2KHCO3
K2CO3+H2O+CO2↑
| ||
2KHCO3
K2CO3+H2O+CO2↑
.
| ||
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放热4947kJ,写出合成塔中反应的热化学方程式
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ/mol
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ/mol
.(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.当电子转移为
1.2
1.2
mol时,参加反应的氧气的体积是6.72L(标准状况下).(4)在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应.有关物质的浓度随时间变化如图所示.

①从反应开始到平衡,H2的平均反应速率v(H2)=
0.225 mol/(L?min)
0.225 mol/(L?min)
.②若其它条件不变,只将温度提高到800℃,再次达平衡时,
| n(CH3OH) |
| n(CO2) |
减小
减小
(填“增大”、“减小”或“不变”).