摘要:反应 A B C D △H/kJ•min-1 16 23 -120 -13 ⊿S/J•mol-1•K-1 40 -110 88 -65 则在任何温度都能自发进行的反应是 ,任何温度都不能自发进行的反应是 ,另两个反应中.在温度高于 ℃时可自发进行的反应是 ,在温度低于 ℃时可自发进行的反应是 . 21. 在密闭容器中.保持一定温度进行如下反应:N2(g)+3H2(g) 2NH3(g).已知加入1 mol N2和3 mol H2.在恒压条件下达到平衡时生成a mol NH3.在恒容条件下达到平衡时生成b mol NH3.若相同条件下.达到平衡时混合物中各组分的百分含量不变.回答下列问题: (1)写出该反应的化学平衡常数表达式:K= . (2)平衡常数K值越大.表明建立平衡时 A. N2的转化率越高 B. NH3的产量越大 C. 正反应进行得越彻底 D. 化学反应速度越快 (3)a与b的关系是:a b填写下表: 22. 在5L的密闭容器中充入2mol A气体和1molB气体.在一定条件下发生反应: 2A 2C(g).达到平衡时.在相同温度下测得容器内混合气体的压强是反应前的.求A的转化率.
网址:http://m.1010jiajiao.com/timu3_id_286140[举报]
某反应A+B?C在任一时刻的正、逆反应速率都可用υ正、υ逆表示:υ正=k1?c(A)?c(B),υ逆=k2?c(C),其中k1、k2在一定温度下恒为 常数,c(A)、c(B)、c(C)分别代表某时刻三种物质的物质的量浓度.
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为 .
(2)在300K时,开始反应的A、B浓度均为0.1mol?L-1,达平衡时B的转化率为50%,则 k1、k2之间的关系是 .
(3)升高温度,k1、k2的变化是 ,k1/k2增大,说明正反应是 (填“吸”或“放”)热反应.
查看习题详情和答案>>
(1)上述反应达到平衡时,三种物质的物质的量浓度关系可表示为
(2)在300K时,开始反应的A、B浓度均为0.1mol?L-1,达平衡时B的转化率为50%,则 k1、k2之间的关系是
(3)升高温度,k1、k2的变化是
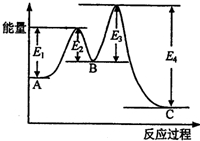 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A、两步反应均为吸热反应 | B、稳定性C>A>B | C、加入催化剂会改变反应的焓变 | D、A?C反应的△H=E1-E4 |
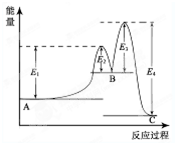 (2013?洛阳一模)某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示能量).下列有关叙述正确的是( )
(2013?洛阳一模)某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示能量).下列有关叙述正确的是( )