摘要:在测定空气中氧气体积分数的实验中.实验结束时.发现水没上升到集气瓶体积的1/5.原因可能有哪些? 剖析:这道题主要从这些方面考虑:有哪些方面有可能使氧气没被消耗完.或有哪些方面即使氧气消耗完但瓶内压强并没有减少那么多. ①未检查装置的气密性.装置漏气,②红磷量不足或燃烧不完全.使瓶内有剩余氧气,③未冷却到室温就打开弹簧夹.使进入瓶内水的体积减少. 问题探究 问题 教材中介绍了测定空气中氧气的体积分数的方法.你能再另外设计实验测定空气中氧气的体积分数吗?请进行探究吧! 探究:实验设计:在加热的情况下.铜能跟空气中的氧气反应.生成黑色的氧化铜. 图2-2 在由两个注射器组成的密闭系统内留有30 mL空气.给装有细铜丝团的玻璃管加热.同时交替缓慢推动两个注射器活塞.观察发生的现象.停止加热后冷却至室温.将气体全部推至一只注射器中.读出注射器内气体的体积. 实验数据: 反应前注射器内气体的体积 反应后注射器内气体的体积 消耗掉的氧气体积 30mL 24mL 6ML 实验结论:氧气的体积大约占空气体积的1/5. 典题精讲 例1 下列是我们日常生活中接触到的物质.其中属于纯净物的是( ) A.碘酒 B.蒸馏水 C.可乐饮料 D.铝合金 思路解析 纯净物中只含一种物质.碘酒是在酒中加了碘.故它是混合物,蒸馏水中只含有水.是纯净物,可乐饮料中加了一些其他物质.是混合物,铝合金中也不只是有铝.是混合物. 答案:B 例2 我们已经知道空气的主要成分是氮气和氧气.如图2-3所示为测定空气中氧气含量的实验装置示意图. 图2-3 (1)实验时.燃烧匙里为什么要盛过量的红磷? (2)这个实验除了可以得出氧气占空气体积的1/5的结论外.还可以得出有关氮气物质的哪些结论? (3)如何证明生成的白色固体溶入水后的溶液显酸性? 思路解析 本题中用燃烧红磷的方法除去一定体积的空气中的氧气.再通过水面升高的情况来判定空气中氧气的体积分数.这就要求:①红磷必须过量.才能把一定体积的空气中的氧气完全消耗掉, ②产物不能是气体.否则无法测定实验结果.因此.实验中使用红磷作燃烧物.且必须过量.由此可推出:在点燃条件下.氮气跟红磷.氧气.五氧化二磷均不反应.氮气难溶入水.红磷燃烧产生大量白烟.生成五氧化二磷固体.当五氧化二磷沉降下来溶解入水时.发生下列化学反应:3H2O+P2O5==2H3PO4,由于有H3PO4生成.故其水溶液显酸性.可使紫色石蕊试液变成红色. 答案:(1)红磷过量才能将空气中的氧气消耗完全.测出的氧气体积才更接近空气中氧气的实际体积.(2)难溶入水.化学性质不活泼.(3)将燃烧匙中的白色固体加入一支试管中.加水溶解.再滴加紫色石蕊试液.石蕊试液变为红色.证明生成的白色固体溶入水后的溶液显酸性. 知识导学 本实验的原理: 在一定量的空气中.利用过量红磷的燃烧完全消耗其中的氧气而又不产生其他气体.导致压强减小.减小的体积即为空气中氧气的体积.即上升水的体积就是氧气的体积. 本实验成功的关键: ①装置不漏气.因为若装置漏气.虽然装置内气体压强减小.但是从外界又进入一些气体.并不能使压强减小很明显.因而水并不能上升到集气瓶中. ②燃烧匙里要放入过量的红磷.目的是使红磷燃烧.尽可能消耗尽钟罩内的氧气. ③应该到温度冷却到室温时才可以观察.因为如果温度较高.虽然气体减少.但是压强并不能减少很明显.因而不能上升到集气瓶体积的1/5. 红磷燃烧时生成无氧化二磷固体小颗粒.因此描述为白烟.烟指的是固体小颗粒. 要点提示: 空气的主要成分是氮气和氧气. 要注意空气中各成分的百分比是体积分数.而不是质量分数. 空气中各成分体积分数一般是比较固定的. 物质可以分为纯净物和混合物. 纯净物可以用化学式来表示.绝对纯净的物质是没有的.纯净物是相对而言的. 混合物中各成分保持各自的性质. 根据氮气的性质得知其用途广泛.包括: 制硝酸和化肥的主要原料,由于氮气的化学性质不活泼.常用作保护气,由于其沸点较低.用液态的氮气汽化时吸热来提供低温环境.用作液氮冷冻麻醉剂.超导材料的环境改造剂. 根据稀有气体的性质得知其有广泛用途.包括: ①作保护气.②作电光源.稀有气体在通电时发出不同的光.灯管里充入氩气.通电时发出蓝紫色光,充入氦气发出粉红色光,充入氦气发出红光.③用于激光技术.④氦气可作冷却剂.⑤氙气可作麻醉剂. 知识拓展: 有害气体主要是SO2.NO2和CO.燃料的燃烧及汽车的尾气.其中SO2.NO2是造成酸雨的主要原因. 当进入大气中的某些有害成分的量超过了大气的自净能力.就会对人类和生物产生不良的影响. 疑难导析 本题综合考查物质的物理性质和化学性质.以及考查了测定空气中氧气体积分数实验的实验原理.实验成功的关键之一是保证装置内气体压强减小很明显.使水能上升到集气瓶. 所以我们要分析红磷.木炭.硫磺.铁丝等物质燃烧前后能否保证装置内气体压强减小很明显.由此即可判断测定空气中氧气含量的实验中.应该选用哪些物质. 这里主要考查了测定空气中氧气体积分数实验的实验原理及实验误差分析.要说明水上升体积的多少决定于瓶内压强变化的程度的关系.还要说明影响压强的因素,分以下几种情况分析:①装置的气密性,②消耗氧气的量,③温度. 可见,既然水没能上升到集气瓶体积的1/5.主要从氧气可能没被消耗完的原因.或即使氧气被消耗完而又有其他气体进来的原因.或温度较高时压强也较大等方面分析. 问题导思 先弄清本实验的原理.就是用可燃物燃烧生成固体物质.除去氧气.减少密闭系统内的压强.再利用压强差.使水进入.测出氧气的体积.或利用压强差.使密闭系统的活塞移动.根据活塞移动的体积测出氧气的体积.由此选择与氧气发生反应的可燃物质就必须满足三个条件:①与空气中的氧气能发生反应,②只与空气中氧气发生反应,③与氧气反应后的生成物质状态不能是气态.对照这三个条件.我们除了可以选择红磷外.还可以选择铜丝.为了便于加热铜丝.我们把铜丝放在细的玻璃管内.铜丝消耗密闭系统内氧气.使压强减小.因而活塞向里移动.使密闭系统内的气体减少.所以通过测量密闭系统内气体体积的较少量.就是氧气的体积.从而测知空气中氧气的含量. 典题导考 绿色通道 纯净物只含一种物质.有固定的组成.能用化学式来表示,混合物含多种物质. 典题变式 下列各组物质中.都属于混合物的是( ) A.海水.水银 B.干冰.冰水混合物 C.不锈钢菜刀.铁矿石 D.石墨.氧化铁 答案:C 绿色通道 测定空气中氧气体积分数试验的实验原理就是用可燃物燃烧生成固体物质.除去氧气.减少密闭系统内的压强.利用压强差.使水进入.测出氧气的体积. 典题变式 某同学用图2-4所示装置粗略测定了空气中氧气的体积分数.图中烧杯上方的玻璃管中部有一可以滑动的活塞.活塞的左端管内有密封的空气.活塞右端的玻璃管口跟空气相通.实验开始前活塞处在5 cm刻度处. 图2-4 (1)向烧杯中加适量水.与生石灰反应放热.目的是 . (2)可以观察到玻璃管内发生的现象是:①白磷 ,②活塞开始向 移动,③随着温度的降低.最终向 移动. (3)实验结束并恢复至室温时.活塞应停在约 cm处.据此可得出的结论是 . 答案:(1)使玻璃管内温度升高.达到白磷的着火点.使白磷燃烧 (2)①燃烧 ②右 ③左 (3)4 空气中氧气的体积大约占1/5
网址:http://m.1010jiajiao.com/timu3_id_28588[举报]
 右图是测定空气中氧气体积分数的实验装置.
右图是测定空气中氧气体积分数的实验装置.(1)盛放在燃烧匙内的物质选用
C
C
(填标号).A.木炭 B.铁丝 C.红磷 D.蜡烛
(2)实验中观察到在集气瓶内产生
浓厚的白烟
浓厚的白烟
,燃烧停止一段时间后,打开止水夹,进入集气瓶的水约占集气瓶总容积的五分之一
五分之一
.(3)若实验后发现测定结果与实际值相差较大,可能的原因是
红磷用量不足
红磷用量不足
(填一种即可). 如图是测定空气中氧气体积分数的实验装置.
如图是测定空气中氧气体积分数的实验装置.(1)装置连接好后应选
检查装置的气密性
检查装置的气密性
后放入药品.(2)盛放在燃烧匙内的物质可选用
C
C
(填标号)A、木炭B、铁丝C、红磷D、蜡烛
(3)把装满燃烧药品的燃烧匙伸入集气瓶中,塞紧橡皮塞,此时看到的主要现象是
产生大量的白烟
产生大量的白烟
,该反应的文字表达式是红磷+氧气
五氧化二磷
| ||
红磷+氧气
五氧化二磷
.
| ||
(4)燃烧停止一段时间后,打开止水夹,进入集气瓶的水约占集气瓶总容积的
五分之一
五分之一
.(5)若实验后发现测定结果与实际值相差较大,可能的原因是
红磷用量不足
红磷用量不足
(填一种即可). 右图是测定空气中氧气体积分数的实验装置.
右图是测定空气中氧气体积分数的实验装置.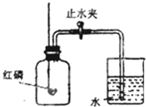 如图是测定空气中氧气体积分数的实验装置.
如图是测定空气中氧气体积分数的实验装置.