摘要:探究结论 ①污染湖泊.江河.导致鱼类死亡.影响水中动植物生长和繁殖,②使土壤酸化.破坏农作物和森林的生长,③酸雨腐蚀金属.建筑材料等,④直接危害人体健康.引起人类肺水肿等疾病,⑤引起河流.湖泊水体酸化. 典题精讲 例1 我国三峡工程所提供的水电.相当于每年燃烧3000万吨原煤的火力发电站产生的电能.因此三峡工程有助于控制( ) A.温室效应 B.白色污染 C.酸雨产生 D.农药.化肥污染 思路解析:煤的主要成分是碳.还有少量硫.氮等.它燃烧时产生的CO2气体是温室气体.产生的SO2和氮的氧化物易形成酸雨.所以水电代替煤燃烧有利于控制温室效应和酸雨的形成. 答案:AD 例2 下列变化过程属于化学变化的是( ) A.分离液态空气制氧气 B.分馏石油制汽油 C.制糖工业中用活性炭脱色制白糖 D.将煤炼制成煤气 思路解析: 分离液态空气制氧气和分馏石油制汽油都是根据混合物中各组成成分的沸点不同分离物质,活性炭具有吸附性.吸附一些食品和工业产品里的色素.这个过程没有新物质生成.是物理变化,工业上将煤隔绝空气加强热使煤分解而产生焦炭.煤焦油和焦炉气等新物质.这个过程是化学变化. 答案:D 知识导学 煤中含有少量的硫.氮等元素.在燃烧时排出污染物.它们溶于水会形成酸雨.因此为了保护环境.应该使用脱硫煤. 燃料燃烧对空气造成的危害主要有两点:①形成酸雨(主要由二氧化硫等气体造成),②形成温室效应(主要由二氧化碳.甲烷.氟氯烃.一氧化二氮等造成). 乙醇属于可再生的清洁能源. 氢气虽然是最清洁的燃料.但是使用不当会发生危险. 疑难导析 燃料燃烧对环境造成的影响可从以下几个方面考虑: ①煤.汽车用燃料的成分,完全燃烧产生什么物质,排到环境中会产生什么影响.对人的健康.植物生长.自然资源以及建筑物等造成怎样的危害. ②煤.汽车用燃料不完全燃烧产生什么物质,排到环境中产生什么影响等.对人的健康.植物生长.自然资源以及建筑物等造成怎样的危害. 问题导思 设计实验前先了解酸雨的组成.是哪些物质造成酸雨的形成.然后思考制造这些物质需要哪些仪器.药品.最后设计实验用这些物质(本次探究制造的物质是SO2.所用的药品是硫粉和氧气)与树叶.镁条.大理石等物质接触.观察有何变化.根据实验现象并查阅资料.可总结出硫燃烧后产物对环境会造成哪些方面的破坏. 用树叶.镁条.大理石等物质实验可以推断出酸雨对农作物.金属.建筑材料等的危害. 典题导考 绿色通道 通过一些题目来认识燃烧煤产生的对环境的危害.从而提高认识. 典题变式 减少“酸雨 产生的措施:①少用煤作燃料,②把化工厂烟囱造高,③在酸化的土壤中加石灰,④燃料脱硫,⑤开发新能源.其有效措施是( ) A.①②③ B.②③④ C.①④⑤ D.①③④ 答案:C 黑色陷阱 石油是一种混合物.它的蕴藏量是有限的,石油不能直接用作飞机燃料. 典题变式 下列变化属于化学变化的是( ) A.石油蒸馏 B.煤干馏 C.干冰升华 D.煤燃烧 答案:BD
网址:http://m.1010jiajiao.com/timu3_id_28582[举报]
26、化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?
【猜想与假设】
猜想1:在常温下能反应;
猜想2:在常温下不能反应,但在加热条件下能反应;
猜想3:在加热条件下也不能反应.
【实验与事实】
操作1:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
操作2:加热该试管,铜片上有气泡生成,并闻到刺激性气味;
操作3:检验产生的有刺激性气味的气体(检验方法及现象略);
操作4:立即停止加热;
操作5:将试管中的残液慢慢倒入少量水中,溶液呈蓝色
【结论与解释】
(1)由以上探究可知猜想
(2)经检验产生的气体是SO2,立即停止加热是为了避免产生更多的SO2;
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4.
【反思与评价】
(4)操作5中,从安全角度考虑(填“能”或“不能”)
(5)探究结论中对产物是SO2和CuSO4的判断是否正确
【拓展与应用】根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4
乙方案:a、在加热条件下将废铜屑在空气中氧化成CuO,b、再将CuO与稀硫酸反应制取CuSO4.
(6)从安全、节约、环保等方面进行评价,较好的方案是乙,理由是:
查看习题详情和答案>>
【猜想与假设】
猜想1:在常温下能反应;
猜想2:在常温下不能反应,但在加热条件下能反应;
猜想3:在加热条件下也不能反应.
【实验与事实】
操作1:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
操作2:加热该试管,铜片上有气泡生成,并闻到刺激性气味;
操作3:检验产生的有刺激性气味的气体(检验方法及现象略);
操作4:立即停止加热;
操作5:将试管中的残液慢慢倒入少量水中,溶液呈蓝色
【结论与解释】
(1)由以上探究可知猜想
2
正确的.(填序号)(2)经检验产生的气体是SO2,立即停止加热是为了避免产生更多的SO2;
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4.
【反思与评价】
(4)操作5中,从安全角度考虑(填“能”或“不能”)
不能
将水倒入剩余的残液里.(5)探究结论中对产物是SO2和CuSO4的判断是否正确
不正确
,理由
反应前后元素种类不同(或生成物中不含氢元素)
.【拓展与应用】根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4
乙方案:a、在加热条件下将废铜屑在空气中氧化成CuO,b、再将CuO与稀硫酸反应制取CuSO4.
(6)从安全、节约、环保等方面进行评价,较好的方案是乙,理由是:
不使用浓硫酸,安全,(或节约硫酸,不污染环境)
,b的化学方程式为
CuO+H2SO4=CuSO4+H2O
.22、我市某河毗邻工业区,近日河里有大量鱼虾死亡.小华闻讯后,立即去该河取回水样,与同学们一起探究河水污染的原因.
(1)过滤,观察水质,发现水质的能见度较低.过滤时无需用到以下仪器的( E )
A 漏斗 B烧杯 C玻璃棒 D铁架台 E酒精灯
(2)小华怀疑工业区有碱性物质排入河中,他取过滤后的水样,用两种不同类型的物质来检验该水样是否呈碱性,他们选用的物质可能是
请你任选上述两种物质中的一种,设计一个实验进行验证.
(3)若测得水样呈碱性,往此水样中加入硫酸铜溶液,有蓝色沉淀生成,则该水样中含有的一种物质可能是
(4)面对内河严重污染,有人建议:①对排入内河的污水预先进行治理②将江水引入,把内河的污水及污泥冲走,使死水变活③使用成本低,效果好,不产生二次污染的生物酶技术治理内河.以上建议你不同意的是
查看习题详情和答案>>
(1)过滤,观察水质,发现水质的能见度较低.过滤时无需用到以下仪器的( E )
A 漏斗 B烧杯 C玻璃棒 D铁架台 E酒精灯
(2)小华怀疑工业区有碱性物质排入河中,他取过滤后的水样,用两种不同类型的物质来检验该水样是否呈碱性,他们选用的物质可能是
紫色石蕊试液
、无色酚酞试液
.请你任选上述两种物质中的一种,设计一个实验进行验证.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量水样于试管中,滴入几滴无色酚酞试液 | 试液由无色变为红色 | 水样呈碱性 |
NaOH
.(4)面对内河严重污染,有人建议:①对排入内河的污水预先进行治理②将江水引入,把内河的污水及污泥冲走,使死水变活③使用成本低,效果好,不产生二次污染的生物酶技术治理内河.以上建议你不同意的是
②
理由是
会造成二次污染
.8、化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温或短时间加热的条件下均不反应.那么,铜与浓硫酸能否发生反应呢?
[猜想与假设]
猜想1:在常温下能反应;
猜想2:在常温下不能反应,但在加热条件下能反应;
猜想3:在加热条件下也不能反应.
[实验与事实]
操作1:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
操作2:加热该试管,铜片上有气泡生成,并闻到刺激性气味;
操作3:检验产生的有刺激性气味的气体(检验方法及现象略);
操作4:立即停止加热;
操作5:将试管中的残液慢慢倒入少量水中,溶液呈蓝色
[结论与解释]
(1)由以上探究可知猜想
(2)经检验产生的气体是SO2,立即停止加热是为了避免产生更多的SO2;
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4.
[反思与评价]
(1)操作5中,从安全角度考虑(填“能”或“不能”)
(2)探究结论中对产物是SO2和CuSO4的判断是否正确
[拓展与应用]根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4
乙方案:在加热条件下将废铜屑在空气中氧化成CuO,再将CuO与稀硫酸反应制取CuSO4.
请你从安全、节约、环保等方面进行评价,较好的方案是
查看习题详情和答案>>
[猜想与假设]
猜想1:在常温下能反应;
猜想2:在常温下不能反应,但在加热条件下能反应;
猜想3:在加热条件下也不能反应.
[实验与事实]
操作1:将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
操作2:加热该试管,铜片上有气泡生成,并闻到刺激性气味;
操作3:检验产生的有刺激性气味的气体(检验方法及现象略);
操作4:立即停止加热;
操作5:将试管中的残液慢慢倒入少量水中,溶液呈蓝色
[结论与解释]
(1)由以上探究可知猜想
猜想2
正确的.(填序号)(2)经检验产生的气体是SO2,立即停止加热是为了避免产生更多的SO2;
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4.
[反思与评价]
(1)操作5中,从安全角度考虑(填“能”或“不能”)
不能
将水倒入剩余的残液里.(2)探究结论中对产物是SO2和CuSO4的判断是否正确
不正确
,理由是反应前后元素种类不同(或生成物中不含氢元素);
.[拓展与应用]根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑、硫酸为原料制取硫酸铜的实验方案.
甲方案:利用废铜屑和浓硫酸在加热的条件下反应制取CuSO4
乙方案:在加热条件下将废铜屑在空气中氧化成CuO,再将CuO与稀硫酸反应制取CuSO4.
请你从安全、节约、环保等方面进行评价,较好的方案是
乙方案
,理由是:乙方案用稀硫酸,比较安全;硫酸的利用率比甲高;没有污染空气的SO2生成.
.12、下表是某城市某日空气质量报告:
某研究性学习小组对表中首要污染物S0:导致酸雨的成因进行探究.
(提示:S02:是一种无色、有刺激性气味的有毒气体,易溶于水,具有与C0:相似的化学性质)
【探究实验】实验一:用下图所示装置进行实验.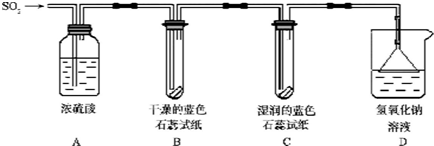
(1)A装置的作用是
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试
纸变红色,说明S02与水反应生成一种
(3)D装置的作用是
实验二:往盛有水的烧杯中通人S02气体,测所得溶液的pH
【查阅资料】S02形成酸雨的另一途径:S02与空气中的02在飘尘的作用下反应生成S03(飘尘的质量和性质在反应前后不发生变化),S03溶于降水生成H2S04.在此过程中飘尘作
【探究结论】S02与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
【模拟实验】
(1)由于食醋和酸雨的酸度(pH)差不多,因此酸雨对大理石的作用可以通过大理石碎片放在醋中来模拟.当把2.0g大理石碎片放在醋中一整夜后,取出固体干燥称重,其质量可能是(醋酸钙易溶于水)
A.小于2.0g B.正好2.0g C.大于2.0g
(2)这组学生还做了另一个实验,即将大理石碎片放在蒸馏水中过夜,其实验的目的是
【知识联想】S02具有与C0:相似的化学性质,根据右图给出的S02及其化合物问的相互转化关系回答:X的化学式是
查看习题详情和答案>>
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | S02 | Ⅱ | 良 |
(提示:S02:是一种无色、有刺激性气味的有毒气体,易溶于水,具有与C0:相似的化学性质)
【探究实验】实验一:用下图所示装置进行实验.

(1)A装置的作用是
干燥
S02气体.(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试
纸变红色,说明S02与水反应生成一种
酸
.(3)D装置的作用是
吸收S02,防止污染空气
,发生反应的化学方程式是S02+2NaOH=Na2S03+H20
.实验二:往盛有水的烧杯中通人S02气体,测所得溶液的pH
<
7(填“>”“=”或“<”),然后每隔l小时测定其pH,发现pH逐渐变小,直至恒定,说明烧杯中溶液被空气中的氧气氧化最终生成H2S04.【查阅资料】S02形成酸雨的另一途径:S02与空气中的02在飘尘的作用下反应生成S03(飘尘的质量和性质在反应前后不发生变化),S03溶于降水生成H2S04.在此过程中飘尘作
催化剂
.【探究结论】S02与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
【模拟实验】
(1)由于食醋和酸雨的酸度(pH)差不多,因此酸雨对大理石的作用可以通过大理石碎片放在醋中来模拟.当把2.0g大理石碎片放在醋中一整夜后,取出固体干燥称重,其质量可能是(醋酸钙易溶于水)
A
.A.小于2.0g B.正好2.0g C.大于2.0g
(2)这组学生还做了另一个实验,即将大理石碎片放在蒸馏水中过夜,其实验的目的是
与实验(1)作对照,证明对大理石起腐蚀作用的是醋酸而不是水
.
【知识联想】S02具有与C0:相似的化学性质,根据右图给出的S02及其化合物问的相互转化关系回答:X的化学式是
H2SO3
,写出X与Na2S03反应的化学方程H2S03+2NaOH═Na2S03+2H20
,反应类型是复分解反应
.