摘要: + 3Cl2(g)===2PCl3(g),△H == -612 kJ·mol-1 (2)PCl5(g)===PCl3(g) + Cl2(g),△H== +93kJ·mol-1 25% 大于 (3)两步反应都是放热反应.降温有利于提高产率.防止产物分解 (4)-399 kJ·mol-1 等于 (5)PCl5 + 4H2O===H3PO4 + 5HCl 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_283951[举报]
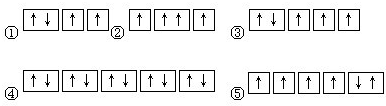
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为
(3)用符号“>”、“<”或“=”表示下列各项关系.
①第一电离能:Na
②电负性:O
③能量高低:ns
④主族序数
查看习题详情和答案>>
②③
②③
,违反了洪特规则的是⑤
⑤
.
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为
1s22s22p63s23p4
1s22s22p63s23p4
;其最高价氧化物对应水化物的化学式是H2SO4
H2SO4
.(3)用符号“>”、“<”或“=”表示下列各项关系.
①第一电离能:Na
<
<
Mg,Mg>
>
Ca.②电负性:O
<
<
F,F>
>
Cl.③能量高低:ns
<
<
(n+1)s,ns<
<
np.④主族序数
=
=
价电子数=
=
元素最高正化合价.
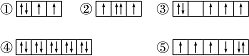
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是 ,违反了洪特规则的是 .
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 .
(3)用符号“>”“<”或“=”表示下列各项关系.
①第一电离能:Na Mg,Mg Ca.
②电负性:O F,F Cl.
③能量高低:ns (n+1)s,ns np.
查看习题详情和答案>>

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为
(3)用符号“>”“<”或“=”表示下列各项关系.
①第一电离能:Na
②电负性:O
③能量高低:ns
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的ΔH表示生成1 mol产物的数据。已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是(?? )
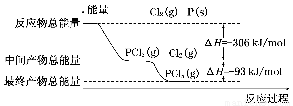
A.其他条件不变,升高温度有利于PCl5的生成
B.反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热 ΔH=-798 kJ/mol
C.P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g) ΔH=-306 kJ/mol
D.其他条件不变,对于2PCl5(g)=2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看习题详情和答案>>
已知2P(s)+3Cl2(g)=== 2PCl3(g) △H=-612kJ·mol-1。
PCl5(g)===PCl3(g)+Cl2(g) △H=93kJ·mol-1。
则P(s)+5/2Cl2(g)=== PCl5(g) 的△H是
A.-705kJ·mol-1 B.-399kJ·mol-1
C.-203kJ mol-1 D.-213kJ·mol-1
查看习题详情和答案>>
|
下列说法中正确的是 | |
A. |
乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 |
B. |
sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 |
C. |
凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 |
D. |
凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 |