摘要: 在一体积为2 L的密闭容器中充入2 mol N2 和5 mol H2 .在一定条件下发生反应: N2 +3H22NH3.4 min后测得N2 还剩余1.2 mol.则在此时间内.用N2表示的反应速率是 A. 0.1 mol/ B. 0.15 mol/ C. 0.3 mol/ D. 0.25 mol/
网址:http://m.1010jiajiao.com/timu3_id_283182[举报]
在某体积为2 L的密闭容器中充入1.5 mol NO2和2 mol CO,在一定条件下发生反应:NO2+CO=CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol,则:
①此段时间内,用CO2表示的平均反应速率为________
②2 min时,容器内气体的总物质的量为________
③假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量________(填“大于”、“小于”或“等于”)2 min时容器内气体的总物质的量.
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)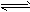 CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图
CO(g)+H2O(g)
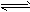 CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图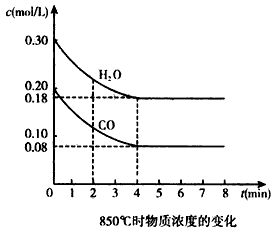
(1)0~4 min的平均反应速率v(CO)____mol/(L·min)。
(2)850℃时,平衡常数K=____。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为_______。
(4)能判断该反应达到化学平衡状态的依据是____(填选项序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
查看习题详情和答案>>
(2)850℃时,平衡常数K=____。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为_______。
(4)能判断该反应达到化学平衡状态的依据是____(填选项序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)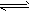 CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图:
CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图:
CO(g)+H2O(g)
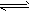 CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图:
CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图: 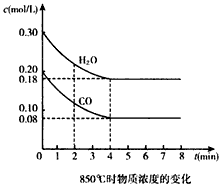
(1) 0~4 min的平均反应速率v(CO)= _____mol/(L·min)。
(2)850℃时,平衡常数K=__________。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0mol H2O,则CO的平衡转化率为_________。
(4)能判断该反应达到化学平衡状态的依据是_______(填选项序号)。
a. 容器中压强不变
b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O)
d. c(CO2)=c(CO)
e. 容器中气体密度不变
f. 1 mol H-H键断裂的同时断裂2mol H-O键
查看习题详情和答案>>
(2)850℃时,平衡常数K=__________。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0mol H2O,则CO的平衡转化率为_________。
(4)能判断该反应达到化学平衡状态的依据是_______(填选项序号)。
a. 容器中压强不变
b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O)
d. c(CO2)=c(CO)
e. 容器中气体密度不变
f. 1 mol H-H键断裂的同时断裂2mol H-O键
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
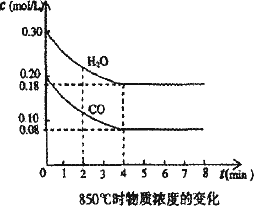
(1)0-4 min的平均反应速率v(CO)=________mol/(L·min).
(2)850℃时,平衡常数K=________.
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为________.
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号).
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6
mol·L-1。下列说法中正确的是