摘要:1.焓 (1)含义: .科学上用焓这一物理量来描述物质的这一固有性质. (2)大小影响因素:对于一定量的纯物质.在一定的状态下.焓有确定的数值.它的数值的大小与物质具有的 有关. ①在同样条件下.物质所具有的能量不同.焓的数值不同, ②同一物质所处的外界条件不同.焓的数值也不同, ③焓的数值大小与物质的量有关.在相同条件下.当物质的量增大l倍时.焙的数值也增大1倍.
网址:http://m.1010jiajiao.com/timu3_id_282932[举报]
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g)
2Z(g)△H<0,4min后达到平衡c(X)=0.2mol?L-1,且X与Y的转化率相等.下列说法中不正确的是( )
| 催化剂 |
| △ |
查看习题详情和答案>>
碳及其化合物有广泛的用途.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 .
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g),△H=+172.5kJ?mol-1
则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极通入的物质是: ,正极反应式为: .
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
通过计算求出该反应的平衡常数(写出计算过程,结果保留两位有效数字) .
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)
2NH3(g),△H=-92.4kJ?mol-1.实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图1.

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 .
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图 .
查看习题详情和答案>>
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g),△H=+172.5kJ?mol-1
则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=
(3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极通入的物质是:
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨.合成氨反应原理为:N2(g)+3H2(g)
| 一定条件 |

请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
下列说法正确的是( )
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ?mol-1 | 348 | 610 | 413 | 436 |
| A、已知某温度下纯水中的c (H+)=2×10-7mol?L-1,据此无法求出水中的c (OH-) |
| B、已知MgCO3的Ksp=6.82×10-6,则在含有固体MgCO3的MgCl2和Na2CO3溶液中,都有c (Mg2+)=c (CO32-),且Ksp (MgCO3)都保持不变 |
C、已知上表数据可以计算出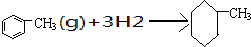 的焓变 的焓变 |
| D、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |