摘要:下列化学式仅代表一种物质的是 A.CH4O B.C3H8O C.C3H6 D.C4H10
网址:http://m.1010jiajiao.com/timu3_id_280573[举报]
 (2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
(2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
.(2)X、Y、Z三种元素第一电离能从大到小顺序为
N>O>C
N>O>C
.(3)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
①该分子中两个Y原子之间的键型组合正确的是
C
C
A.仅1个σ键B.1个σ键和2个π键
C.1个σ键和1个π键D.仅2个σ键
②该分子中Y原子的杂化方式是
sp2杂化
sp2杂化
(4)R2+水溶液中存在配合物离子[R(H2O)4]2+,请画出[R(H2O)4]2+离子的结构式


(5)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是
BCD
BCD
 A.该晶体属于分子晶体
A.该晶体属于分子晶体B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键.
粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如图1所示:
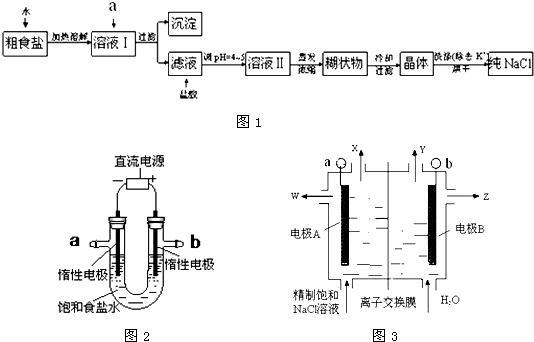
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、KOH溶液、BaCl2溶液、Ba(N03)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为 (填化学式);
(2)蒸发浓缩溶液Ⅱ得到的糊状物的主要化学成分是 (填化学式);
(3)用提纯过的NaCl固体来配制500mL 4.00mol?L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒外还有 (填仪器名称);
(4)电解饱和食盐水的装置如图2所示:若收集到的H2为2L,则同样条件下收集到的Cl2体积 (填“>”、“=”或“<”)2L,其原因是: (文字描述);若将此装置的b口密封住,则电解一段时间后,U型管中可以获得一种消毒液,写出获得此消毒液的一个总反应方程式: .
(5)如图3所示是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过.下列说法正确的是 .
A.B电极反应式:2Cl--2e→Cl2↑
B.W是稀的氯化钠溶液
C.Z是氢氧化钠溶液
D.a是电源负极.
查看习题详情和答案>>

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、KOH溶液、BaCl2溶液、Ba(N03)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为
(2)蒸发浓缩溶液Ⅱ得到的糊状物的主要化学成分是
(3)用提纯过的NaCl固体来配制500mL 4.00mol?L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒外还有
(4)电解饱和食盐水的装置如图2所示:若收集到的H2为2L,则同样条件下收集到的Cl2体积
(5)如图3所示是氯碱工业中应用的立式隔膜电解槽示意图,其中的离子膜仅允许阳离子通过.下列说法正确的是
A.B电极反应式:2Cl--2e→Cl2↑
B.W是稀的氯化钠溶液
C.Z是氢氧化钠溶液
D.a是电源负极.
 北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:(1)火焰利用了部分金属的
(2)如图Ⅰ所示的五圆环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素.A是沼气的主要成分;B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型如图Ⅱ;C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为
②A、B、E中均含有的一种元素为
③NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出E与足量盐酸发生反应的化学方程式
(3)我国科研人员在实验室应用电子计算机模拟出具有高能的物质N60,它的结构与C60十分相似.已知N60分子中每个N原子均以氮氮单键结合三个氮原子,且N60结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60分子的结构中含有
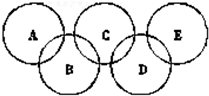 如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:(1)A、B、C、D、E的化学式分别是
CH4、H2O2、SiO2、Si3N4、N2H4
CH4、H2O2、SiO2、Si3N4、N2H4
.(2).A燃烧的化学方程式为
CH4+2O2
CO2+2H2O
| ||
CH4+2O2
CO2+2H2O
.
| ||
(3)B的水溶液呈弱酸性,其电离方程式可表示为
H2O2?HO2-+H+
H2O2?HO2-+H+
.(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
2H2O2+N2H4═N2↑+4H2O
2H2O2+N2H4═N2↑+4H2O
.《物质结构与性质》模块
二茂铁(C5H5)2Fe是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展.二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:2C5H6+Fe(还原铁粉)
(C5H5)2 Fe+H2.
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: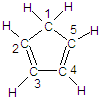 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),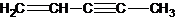 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 .
查看习题详情和答案>>
二茂铁(C5H5)2Fe是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展.二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:2C5H6+Fe(还原铁粉)
| 300℃ | K2O.N2 |
请回答下列问题:
(1)写出二价铁离子的基态电子排布式:
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂.据此可推断二茂铁晶体为
(3)环戊二烯的结构式为:
 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是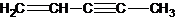 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与N2分子互为等电子体的二价阴离子是