网址:http://m.1010jiajiao.com/timu3_id_280262[举报]
在含有氯化铁、氯化亚铁、氯化铝、氯化钠的混合溶液中加入足量的过氧化钠固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ w.w.w.k.s.5 u.c.o.m C.Fe3+ D.Fe2+
查看习题详情和答案>>在含有氯化铁、氯化亚铁、氯化铝、氯化钠的混合溶液中加入足量的过氧化钠固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
查看习题详情和答案>> 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.(1)铁元素在元素周期表中的位置是
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为
②电池中NaCl的作用是
(3)用铝电池电解CuSO4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为
(4)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
| ||
| ||
(5)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末,常用作颜料.已知氧化亚铜溶于稀硫酸生成Cu和CuSO4.取少量Fe2O3和Cu2O组成的混合物放入足量稀硫酸中.
①此过程中发生的反应有(用离子方程式表示):
Fe2O3+6H+=2Fe3++3H2O;
②设计实验证明反应后所得溶液中铁元素可能存在形式
③若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O)
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
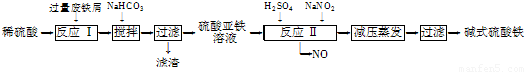
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
查看习题详情和答案>>
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应Ⅰ中发生的氧化还原反应的化学方程式为 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是______________________。
(3)反应Ⅱ的离子方程式为 ___。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____ ____。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液 查看习题详情和答案>>