摘要:9.在1.01×105Pa.120℃时.1L A.B两种烷烃组成的混合气体.在足量的氧气中充分燃烧.得到同温同压下2.5L CO2和3.5L H2O.且A分子比B分子少2个碳原子.计算确定A.B的分子式及体积比.
网址:http://m.1010jiajiao.com/timu3_id_280259[举报]
(8分)碘在科研与生活中有重要的应用。某兴趣小组用0.50mol·L-1KI 、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知S2O82—+2I—=2SO42—+I2 (慢) I2 +2S2O32—=2I—+S4O62—(快)
(1)向KI 、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中 (写离子符号)耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为n(S2O32—)︰n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 | 体积/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | VX | 4.0 | 4.0 | 2.0 |
表中VX= mL,理由是 。 查看习题详情和答案>>
配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的PH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的变化、溶解度的变化、PH值的改变等现象.
Br-与Cu2+反应生成配位化合物,就存在配位平衡:Cu2++4Br-?[Cu Br4]2-
已知:Cu2+在水溶液中显蓝色,[Cu Br4]2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4]2-浓度越大,颜色越深.同时,温度可能对[Cu Br4]2-的稳定性有影响.某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
【假设与猜想】
(1)增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
(2)
作出上述1、2假设与猜想依据的原理是
(3)温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
(4)温度变化也可能使化学平衡向左移动,抑制配合物的形成.
【实验准备】
(1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,分别溶于92g水、42g水、17g水(第三种溶液已饱和)的溶液.
(2)NaBr溶液的准备:分别取2.6g、5.2g、10.4g NaBr固体,分别溶于水配成50ml、50ml、50ml溶液.
问题1:第一份不饱和CuSO4溶液的质量分数是
第一份不饱和NaBr溶液的物质的量浓度分别是
问题2:配制三份不饱和NaBr溶液需要用到的仪器有:
【实验现象】
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
表2、不同浓度的Cu2+溶液与某一浓度的Br-溶液反应
表3、不同温度对配合物形成的影响
问题3:上表中b=
问题4:通过表3得出的结论是
查看习题详情和答案>>
Br-与Cu2+反应生成配位化合物,就存在配位平衡:Cu2++4Br-?[Cu Br4]2-
已知:Cu2+在水溶液中显蓝色,[Cu Br4]2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br4]2-浓度越大,颜色越深.同时,温度可能对[Cu Br4]2-的稳定性有影响.某化学探究小组的同学为了探究温度、浓度对Br-与Cu2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
【假设与猜想】
(1)增大配位离子(Br-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
(2)
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深
.作出上述1、2假设与猜想依据的原理是
勒沙特列原理
勒沙特列原理
.(3)温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
(4)温度变化也可能使化学平衡向左移动,抑制配合物的形成.
【实验准备】
(1)CuSO4溶液的准备:分别取3份8g无水CuSO4固体,分别溶于92g水、42g水、17g水(第三种溶液已饱和)的溶液.
(2)NaBr溶液的准备:分别取2.6g、5.2g、10.4g NaBr固体,分别溶于水配成50ml、50ml、50ml溶液.
问题1:第一份不饱和CuSO4溶液的质量分数是
8%
8%
;第一份不饱和NaBr溶液的物质的量浓度分别是
0.5mol/L
0.5mol/L
.(数字取小数后一位)问题2:配制三份不饱和NaBr溶液需要用到的仪器有:
50mL容量瓶
50mL容量瓶
、托盘天平、烧杯、玻璃棒;【实验现象】
表1、不同浓度的Br-溶液与某一浓度的Cu2+溶液反应
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为深绿色 |
1.0
1.0
e=16%
16%
;问题4:通过表3得出的结论是
该配合物反应是吸热反应
该配合物反应是吸热反应
. A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种.现利用另一种常见溶液X,用下图所示的方法,可将它们一一确定.请回答以下问题:(1)B的化学式是
Ba(NO3)2
Ba(NO3)2
A的电子式为

(2)写出在X溶液中加入过量NH3?H2O的离子反应方程式
Cu2++4NH3?H2O=Cu(NH3)42++4H2O
Cu2++4NH3?H2O=Cu(NH3)42++4H2O
.(3)有学生分别用其他试剂来鉴别上述四种溶液:
①用物质Y一次性鉴别上述四种物质,结果发现第一种溶液中反应后溶液呈黄色,第二种溶液中有白色沉淀产生,第三种溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,则Y是
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
(用化学式表示).Y溶液与稀硝酸反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
.②若用明矾鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子反应方程式:Ba2++SO42-=BaSO4↓、
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.③有学生用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液,发现沉淀均溶解.有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故.
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故.
| 电解质 | HF | HCOOH | CH3COOH | HCN | NH3?H2O |
| 电离度 | 8.00% | 7.16% | 1.32% | 0.01% | 1.33% |
CH3COONH4
CH3COONH4
(用化学式表示).石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一,将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2,并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧后产物体积的3/8(气体体积都在1000C以上,1.01×105Pa时测定)
(1)试写出通式为CxHy的某烃在供氧不足时燃烧的化学方程式(CO2的系数定为m)
(2)当m=2时,求该烃的化学式;
(3)若1mol 某气态烃在供氧不足时,产物在足量的Na2O2和电火花连续作用下产生3mol 氧气,且固体的增重范围为90g≤△W≤118g,求烃可能的化学式和燃烧产物CO与CO2的物质的量之比,将结果填入下表:
查看习题详情和答案>>
(1)试写出通式为CxHy的某烃在供氧不足时燃烧的化学方程式(CO2的系数定为m)
(2)当m=2时,求该烃的化学式;
(3)若1mol 某气态烃在供氧不足时,产物在足量的Na2O2和电火花连续作用下产生3mol 氧气,且固体的增重范围为90g≤△W≤118g,求烃可能的化学式和燃烧产物CO与CO2的物质的量之比,将结果填入下表:
| 烃的化学式 | n(CO)/n(CO2) |
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| | IA | | | | | | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | |
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按
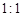 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。a.MnO2 b.Na2SO4 c.Na2SO3 d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
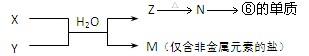
X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH
 。
查看习题详情和答案>>
。
查看习题详情和答案>>