网址:http://m.1010jiajiao.com/timu3_id_279482[举报]
已知2A2(g)+B2(g) ![]() 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
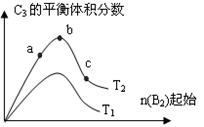
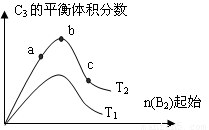
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
查看习题详情和答案>>(12分)已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
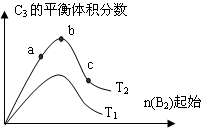
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
查看习题详情和答案>>
(12分)已知2A2(g)+B2(g)  2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定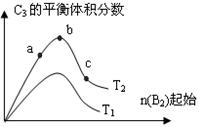
容积的容器中加入2 molA2和1 molB2,在5 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
(12分)已知2A2(g)+B2(g)
 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
查看习题详情和答案>>
 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定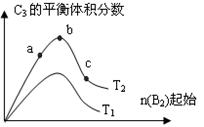
容积的容器中加入2 molA2和1 molB2,在5
 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平
 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。(2)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容
 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。