网址:http://m.1010jiajiao.com/timu3_id_277296[举报]
(8分)在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。认真观察右图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应的△H= kJ•mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
O2(g)= H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
查看习题详情和答案>>
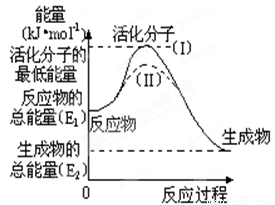
(8分)在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示。认真观察右图,然后回答问题。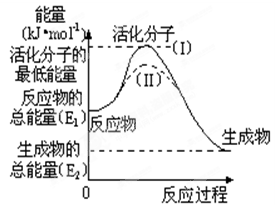
(1)图中反应是 (填“吸热”或“放热”)反应,该反应的△H= kJ?mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+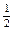 O2(g) = H2O(g) △H=-241.8kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则逆反应的活化能为 。
O2(g) = H2O(g) △H=-241.8kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则逆反应的活化能为 。
(3)对于同一反应,图中虚线( Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
(8分)在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。认真观察右图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应的△H= kJ•mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+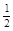 O2(g)
= H2O(g)
△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
O2(g)
= H2O(g)
△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
查看习题详情和答案>>
在化学反应中,只有少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。我们把能引发化学反应的碰撞称为有效碰撞,发生有效碰撞的分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol-1表示。认真观察下图,然后回答问题。
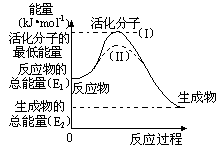 (1)图中反应是 (填“吸热”或“放热”)反应,该反应的△H= (用含E1、E2的代数式表示)。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
O2(g) === H2O(g) △H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 。
(4)标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,未干燥就装待测液
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
查看习题详情和答案>> 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ?mol-1表示.请认真观察下图,然后回答问题.(1)图中反应是
(2)已知热化学方程式:H2(g)+
| 1 | 2 |
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是