摘要:(三)在一道计算题中若同时包含了两种或两种以上的基本计算类型.就属于综合计算.主要类型如下: 1.化学式计算与化学方程式计算的综合 2.溶解度与饱和溶液溶质的质量分数的换算 3.化学方程式计算与溶液计算的综合 其中最常邮的是第3种类型.这类计算的类型有: (1)先根据化学方程式进行计算.将求得的有关纯物质质量作为溶质.再时行关于溶质的质量分数或溶解度的计算.若反应物彼此恰好完全反应.求反应后所得溶液溶质的质量分数时.找准溶液的质量是解题的关键.有两种方法. 质量守恒: 溶液质量=反应物质质量总和-脱离溶液的质量(气体.沉淀.析出晶体.不容杂质等) 溶液组成法: 溶液质量=溶质质量+溶剂质量(原反应物溶液中的水+化学反应中生成的水) 一般用第一种方法计算较为简便. (3)先根据溶质的质量分数和溶液质量算出溶质质量.再代入化学方程式进行有关计算. 综合计算涉及的概念较多.头绪繁杂.在审题时要善于化繁为简.把复杂问题分解成几个简单问题求解.同时在解题过程中要做到思路清晰.步骤完整.计算准确.格式规范.还要注意单位和精确度要求. 例1.(2002 北京市四城区中考题) 实验定有一瓶存放时间较长的氢氧化钠.其中的一部分已转化成碳酸钠.现要用该药品配制10%的氢氧化钠溶液.取50.6g该药品.溶于200mL水中.然后慢慢地滴入17.1%的氢氧化钡溶液.当用去100g氢氧化钡溶液时.碳酸钠恰好反应完全.求: (1)50.6该药品中碳酸钠的质量. (2)滤出沉淀后所得溶液中溶质的质量和溶液的质量. (3)向所提溶液中再加入多少毫升水才能配制成10%的氢氧化钠溶液. [解析]这是一道涉及到溶液和化学方程式的综合计算题. 设50.6g该药品中碳酸钠的质量为x.生成碳酸钡和氢氧钠的质量分别为y和z. 2的质量=100g×17.1%=17.1g Na2CO3+Ba(OH)2===BaCO3↓+2NaOH 106 171 197 80 x 17.1g y z = x=10.6g = y=19.7g = z=8g (2)NaOH溶液中溶质的质量为: 50.6g-10.6g+8g=48g NaOH溶液的质量为: 50.6g+200mL×1g/mL+100g-19.7g=300.9g (3)需加入水的体积为: ÷1g/mL=149.1mL 答:略 例2.(2002年 福建省泉州市中考题) 工业上常用废铜屑跟热的稀硫酸和氧气反应制取硫酸铜: 2Cu+O2+2H2SO4===2CuSO4+2H2O 现将25.6吨废铜屑和368吨热的稀硫酸混合.通入足量的氧气.恰好完全反应.试计算: (1)参加反应的氧气有多少吨? (2)可制得我水硫酸铜多少吨? (3)反应后溶液中CuSO4的质量分数是多少? [解析] 尽管这个化学反应是新遇到的.但是所涉及的计算步骤和方法应该是熟悉的. 设参加反应的O2的质量为x.生成的CuSO4质量为y. 2Cu + O2+2H2SO4 2CuSO4+2H2O 2×64 32 2×160 25.6T x y = x=6.4T = y=64T CuSO4的质量分数=×100%=16% 答:参加反应的O2有6.4T,可制得无水硫酸铜的64T,CuSO4溶液中溶南的质量分数为16%. 例3. 石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数.取来了一些矿石样品.并取稀盐酸200g.平均生成4份.进行实验.结果如下: 实验 1 2 3 4 加入样品的质量/g 5 10 15 20 生成CO2的质量/g 1.76 3.52 4.4 m (1)哪几次反应中矿石有剩余? . (2)上表中m的数值是 . (3)试计算这种石灰石矿中碳酸钙的质量分数. [解析] 要善于分的所给的实验数据.并能透过现象看本质.将稀盐酸分成4分.每份为50g. 第一次加入5g样品生成1.76gCO2.而第二次加入10g样品.生成CO2的质量为1.76g×2=3.52g.第三次加入15g样品.生成CO2的质量为4.4g≠1.76g×3.说明从第三次开始.样品均过量.即产生CO2的量决定于盐酸的量.由此可见:
网址:http://m.1010jiajiao.com/timu3_id_27337[举报]
学习中和反应时,老师和同学们展开了如下探究:
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入盛有NaOH溶液的烧杯中,并用温度计测量温度变化.
小军发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低.对此合理的解释是
【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小雯同学在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌).
①通过实验现象,小雯排除了实验B,你认为她的理由是
②实验C中溶液的颜色最终变成了红色,但也被排除,原因是
③实验时,老师告诉小雯:相对于实验A,实验D也有不足.通过下面的资料,你认为理由是
【资料卡片】:
紫色石蕊试液和无色酚酞试液在不同酸碱性溶液中的变色情况
④小杰认为:将NaOH溶液和稀盐酸混合后的溶液蒸干,若得到白色固体,则说明反应生成NaCl,从而确认反应已发生,你认为这种观点是否正确,并说出理由?
【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:
①实验1所得溶液沸腾时的温度
②实验后溶液一定显碱性的试管有
③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识?
(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是
【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小江同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:
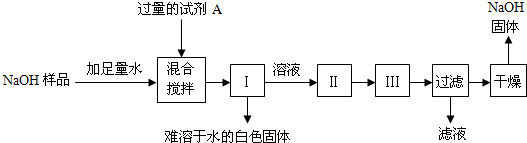
①试剂A是
②操作名称:Ⅰ
③为获得纯度较高的NaOH固体,小江同学应在干燥前将其用
【探究五】:测定NaOH样品中NaOH的质量分数
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收).
求:①样品中NaOH的质量分数(精确到小数点后一位);
②在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确);解题过程:
【反思】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?
【拓展提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?
查看习题详情和答案>>
【探究一】:探究实验过程中的能量变化
用胶头滴管将10%的稀盐酸逐滴加入盛有NaOH溶液的烧杯中,并用温度计测量温度变化.

小军发现:随着稀盐酸的不断滴入,溶液的温度先升高后降低.对此合理的解释是
盐酸和氢氧化钠溶液反应要放出热量,等反应完全后不再放热,
盐酸和氢氧化钠溶液反应要放出热量,等反应完全后不再放热,
而加入的盐酸会使溶液的温度降低
而加入的盐酸会使溶液的温度降低
;【探究二】:探究反应发生及反应终点问题
实验中,除了温度有变化外,没有任何现象能证明反应是否发生及反应是否已至终点,小雯同学在老师的帮助下,进行了下图所示的探究实验(滴加试剂时同时搅拌).
①通过实验现象,小雯排除了实验B,你认为她的理由是
石蕊遇碱变蓝,遇中性溶液变紫,而这两种颜色比较接近,现象不明显
石蕊遇碱变蓝,遇中性溶液变紫,而这两种颜色比较接近,现象不明显
;②实验C中溶液的颜色最终变成了红色,但也被排除,原因是
溶液变为红色,表明盐酸和氢氧化钠反应,但是滴加的氢氧化钠过量,不容易判断终点,所以该方案不合适
溶液变为红色,表明盐酸和氢氧化钠反应,但是滴加的氢氧化钠过量,不容易判断终点,所以该方案不合适
;③实验时,老师告诉小雯:相对于实验A,实验D也有不足.通过下面的资料,你认为理由是
根据资料可以知道溶液只有达到弱碱性时石蕊才会变成紫色,而盐酸和氢氧化钠恰好完全反应时溶液呈中性,所以滴加的氢氧化钠溶液依然过量,所以该方案不合适
根据资料可以知道溶液只有达到弱碱性时石蕊才会变成紫色,而盐酸和氢氧化钠恰好完全反应时溶液呈中性,所以滴加的氢氧化钠溶液依然过量,所以该方案不合适
;【资料卡片】:
紫色石蕊试液和无色酚酞试液在不同酸碱性溶液中的变色情况
| 紫色石蕊试液 | pH<5.0:红色 | 5.0<pH<8.0:紫色 | pH>8.0:蓝色 |
| 无色酚酞试液 | pH<8.2:无色 | 8.2<pH<10.0:红色 | pH>10.0:无色 |
不正确;氢氧化钠也为白色固体
不正确;氢氧化钠也为白色固体
.【探究三】:探究实验过程中的意外情况
(1)为了提高实验的趣味性,老师演示了如下图所示的连贯实验,回答下列问题:

①实验1所得溶液沸腾时的温度
>
>
100℃(填“>”、“<”或“=”);②实验后溶液一定显碱性的试管有
4
4
支,实验3后溶液中NaOH质量分数>
>
(填“>”、“<”或“=”)实验2后溶液中NaOH质量分数;③通过上述探究,你对酚酞试液在碱性溶液中的颜色变化有何新的认识?
在温度较高的时候酚酞在碱性溶液中不会变红.
在温度较高的时候酚酞在碱性溶液中不会变红.
;(2)小岳在他的实验过程中意外发现有气泡出现,你认为原因是
氢氧化钠变质
氢氧化钠变质
.【探究四】:从部分变质的NaOH样品中回收较为纯净的NaOH
小江同学查阅了不同温度下NaOH的溶解度(见资料卡片),并按如下步骤进行了实验(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
【资料卡片】:
| 温度/°C | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 64 | 85 | 138 | 203 | 285 | 376 |

①试剂A是
Ca(OH)2
Ca(OH)2
(填化学式)溶液;②操作名称:Ⅰ
过滤
过滤
、Ⅱ蒸发
蒸发
、Ⅲ降温结晶
降温结晶
;③为获得纯度较高的NaOH固体,小江同学应在干燥前将其用
饱和的氢氧化钠溶液来洗涤所得晶体
饱和的氢氧化钠溶液来洗涤所得晶体
进行淋洗.【探究五】:测定NaOH样品中NaOH的质量分数
小海取13.5g部分变质的NaOH固体样品加适量的水配成溶液,向其中加入足量质量分数为7.3%的稀盐酸,使其充分反应,生成二氧化碳2.2g(假设生成的CO2被完全吸收).
求:①样品中NaOH的质量分数(精确到小数点后一位);
②在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸质量的关系图(不要求精确);解题过程:
①设混合物中碳酸钠的质量为x,消耗盐酸的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
=
=
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
×100%=60.7%
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
| 13.5g-5.3g |
| 13.5g |
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:

①设混合物中碳酸钠的质量为x,消耗盐酸的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
=
=
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
×100%=60.7%
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:
;Na2CO3+2HCl═2NaCl+H2O+CO2↑
10673 44
xy?7.3%2.2g
| 106 |
| x |
| 73 |
| y?7.3% |
| 44 |
| 2.2g |
解得:x=5.3g,y=50g
所以氢氧化钠的质量分数为:
| 13.5g-5.3g |
| 13.5g |
②根据①的解答可以知道,生成2.2g二氧化碳需要盐酸的质量为50g
故可以作图如下:


【反思】:经过讨论,大家一致认为小海方法有误,求出的NaOH的质量分数比实际值大,造成错误最有可能的原因是什么?
根据氢氧化钠变质的过程可以知道,氢氧化钠要先吸收水分潮解后然后才会和二氧化碳反应,所以13.5g样品中包含了水的质量,而计算时没有考虑到吸收的水的质量,故会使求得的氢氧化钠的质量分数偏大
根据氢氧化钠变质的过程可以知道,氢氧化钠要先吸收水分潮解后然后才会和二氧化碳反应,所以13.5g样品中包含了水的质量,而计算时没有考虑到吸收的水的质量,故会使求得的氢氧化钠的质量分数偏大
;【拓展提高】:欲使实验结果准确可靠,你对小海的实验会做怎样的改进?
将氢氧化钠样品烘干后进行实验
将氢氧化钠样品烘干后进行实验
.