网址:http://m.1010jiajiao.com/timu3_id_273224[举报]
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;将第三份加热,看到溶液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.
请回答:
(1)请写出实验室制备氯气的离子方程式
(2)反应后所得的溶液漂白性增强的原因是

实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是
(1)此消毒液可吸收空气中的CO2生成NaHCO3而变质.写出化学反应方程式 .
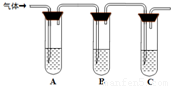
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分可以判断消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol?L-1 KI-淀粉溶液、1.0mol?L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案.
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② . |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质. |
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol?L-1Na2SO3溶液b mL;
②滴定分析.将c mol?L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据.重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为 mol?L-1(用含a、b、c、v的代数式表示).

(1)此消毒液可吸收空气中的CO2生成NaHCO3而变质.写出化学反应方程式______.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分可以判断消毒液是否变质.
限选试剂:98%浓硫酸、1%品红溶液、1.0mol?L-1 KI-淀粉溶液、1.0mol?L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案.
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量①______; 试管B中加1%品红溶液; 试管C中加②______. | 若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊.则消毒液部分变质; ③______则消毒液未变质; ④______则消毒液完全变质. |
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol?L-1Na2SO3溶液b mL;
②滴定分析.将c mol?L-1的酸性KMnO4溶液装入______(填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据.重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O.
③计算.消毒液中NaClO的浓度为______mol?L-1(用含a、b、c、v的代数式表示).
 查看习题详情和答案>>
查看习题详情和答案>>
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ = Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
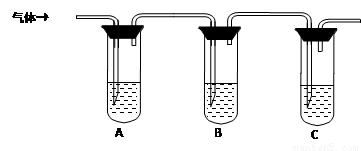
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、澄清石灰水、饱和NaCl溶液
请完成下列实验方案。
|
所加试剂 |
预期现象和结论 |
|
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 |
若A中溶液变蓝色,B中溶液不退色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不退时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO + Na2SO3 = NaCl + Na2SO4 ;
2KMnO4 + 5Na2SO3+ 3H2SO4 = K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。
查看习题详情和答案>>
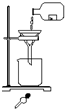 某学生发现滴瓶中溶液变浑浊,拟用右图所示操作进行过滤,错误的操作有( )
某学生发现滴瓶中溶液变浑浊,拟用右图所示操作进行过滤,错误的操作有( )