网址:http://m.1010jiajiao.com/timu3_id_272805[举报]
| 沸点/℃ | 水溶性 |
甲醇 | 65 | 与水混溶 |
甲醛 | -21 | 与水混溶 |
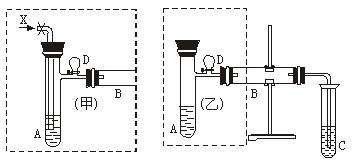
图15-18是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试完成下列问题:?
?
图15-18
(1)若按(甲)装置进行实验,则通入A管的X是 ,B中反应的化学方程式为 。
(2)若按(乙)装置进行实验,则B管中应装 ,反应的化学方程式 。?
(3)C中应装的试剂是 。?
(4)在仪器组装完成后,加试剂前都必须要进行的操作是? ?,若添加药品后,如何检验乙装置的气密性? 。??
(5)两种装置中都需加热的仪器是 (填A、B、C),加热的方式分别为 ,实验完成时,都应先停止对? ?(填A、B、C)加热,再 。若实验完成时先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是? ?。简述工作原理 。
(6)你认为用哪套装置较好 (填“甲”或“乙”),理由是? 。?
查看习题详情和答案>>
| 沸点/℃ | 水溶性 |
甲醇 | 65 | 与水混溶 |
甲醛 | -21 | 与水混溶 |
下图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答。

(1)若按(甲)装置进行实验,则通入A管的X是__________________,B中反应的化学方程式为________________。
(2)若按(乙)装置进行实验,则B管中应装,反应的化学方程式为___________________。
(3)C中应装的试剂是_______________。
(4)在仪器组装完成后,加试剂前都必须进行的操作是______________,添加药品后,如何检验乙装置的气密性?________________。
(5)两种装置中都需加热的仪器是__________(填“A”“B”或“C”),加热的方式分别为,实验完成时,都应先停止对________ (填“A”“B”或“C”)加热,再________。若实验完成时,应先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是________________,简述工作原理:__________________________________。
(6)你认为用哪套装置较好?________________
(填“甲”或“乙”),理由是 ________________ 。
| 沸点(℃) | 水溶性 |
甲醇 | 65 | 与水混溶 |
甲醛 | -21 | 与水混溶 |
下图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如图(甲)和(乙)所示,试回答:
甲 乙
(1)若按甲装置进行实验,则通入A管的X是__________;B中反应的化学方程式为______________________。
(2)若按乙装置进行实验,则B管中应装入__________,反应的化学方程式为_________。
(3)C中应装的试剂是__________。
(4)在仪器组装完成后,加试剂前都必须要进行的操作是_________,若添加药品后,如何检验乙装置的气密性?__________。
(5)两种装置中都需加热的仪器是________(填“A”“B”或“C”),加热的方式分别为_________,实验完成时,都应先停止对________(填“A”“B”或“C”)加热,再____________。若实验完成时先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是_________________,简述工作原理______________________。
(6)你认为用哪套装置较好________(填“甲”或“乙”),理由是____________________。
查看习题详情和答案>>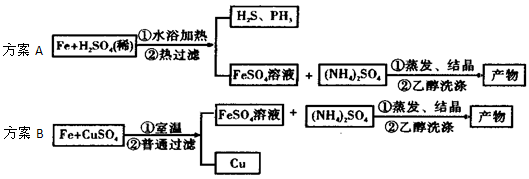
(1)实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有________ (填编号)。
①铁架台 ②玻璃棒 ③广口瓶 ④石棉网 ⑤烧杯 ⑥漏斗 ⑦酒精灯
(2)方案A中FeSO4溶液的制备:将处理好的铁屑放入锥形瓶,加入过量的3 mol/LH2SO4溶液,加热至充分反应为止。趁热过滤,收集滤液和洗涤液。下右图装置中方框内选择更适合用于实验方案A的装置是__________ (填“甲”或“乙”)。

(4)实验方案B中FeSO4溶液的制备:用“五水硫酸铜结晶水的测定”实验中的废弃物--无水硫酸铜粉末代替稀硫酸与铁屑反应制备硫酸亚铁。当用无水硫酸铜配制的溶液由蓝色完全变为浅绿色时停止反应,过滤,收集滤液即得硫酸亚铁溶液。此方案的优点有_________ (填编号)。
a. 充分利用了实验室废弃物--硫酸铜粉末,避免了药品浪费,又回收了金属铜,实现了变废为宝
b. 避免了有毒气体的排放对环境造成的污染
c. 原子利用率达到100%
d. 避免了在加热中Fe2+被氧化成Fe3+, 有利于产品质量等级的提高,并节约了能源
(5)产品中Fe3+杂质的定量分析
①配制Fe3+浓度为1.0mg/mL的标准溶液100mL。称取_________mg高纯度的硫酸铁铵(NH4)Fe(SO4)2·12H2O,加 2.00 mL经处理的去离子水,振荡溶解后,加入2mol/L HBr 溶液 l m L和 l mol/L KSCN溶液0.5 mL,加水制成100 mL溶液。配制过程中必须用到的定量仪器为________(选填编号)。
a. 精确度为0.001g的电子天平
b.精确度为0.1mg的电子天平
c.100 mL容量瓶
d.酸式滴定管
e.10mL量筒
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液。分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

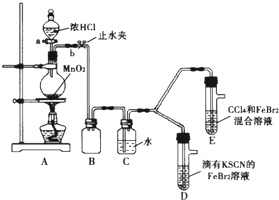 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因