摘要:4.下列仪器中.具有溶解固体.配制溶液和加热较多量液体这三种用途的是( ) A.试管 B.量筒 C.集气瓶 D.烧杯
网址:http://m.1010jiajiao.com/timu3_id_27220[举报]
在生产生活中,你会发现“化学就在身边”.
(1)将下列各名词的序号填在与之相对应的空格中.
a.乳化 b.密度 c.气味 d.颜色 e.溶解性
①用洗洁精洗涤有油污的碗筷,是因为洗洁精具有_____作用;
②由于氦气的 _____ 小且化学性质不活泼,因此常被用来填充气球;
③由于固体氯化钙和碳酸钙的 _____不同,所以可以用水加以区分;
④我们可以根据酒精、白醋和水的 _____ 明显不同来区分它们.
(2)根据用途,选择相应的仪器,将它们的序号字母填在相应位置.
A.试管 B.烧杯 C.坩埚钳 D.铁架台 E.胶头滴管
①在做镁条燃烧实验时,用于夹持镁条的仪器是 ______ ;
②溶解较多量的固体用到的容器是 ____ ;
③可以直接在酒精灯火焰上加热的玻璃仪器是 ____ ;
④取用少量液体药品的仪器是 ____.
(3)按下图配方可配制一瓶清凉甘甜的汽水. 根据图中信息回答:
①小苏打中含有的金属元素的名称是 ____ ;
②汽水中含量最多的物质的化学式是 ____ ;
③打开瓶盖产生气体,说明气体溶解度与 ______ 有关;
④配制汽水时发生反应的化学方程式为:3NaHCO3+H3R=Na3R+3H2O+3X↑,则X的化学式是 ______;
⑤白糖的主要成分是C12H22O11,其中碳、氢两种元素的质量比是 _______ .
(1)将下列各名词的序号填在与之相对应的空格中.
a.乳化 b.密度 c.气味 d.颜色 e.溶解性
①用洗洁精洗涤有油污的碗筷,是因为洗洁精具有_____作用;
②由于氦气的 _____ 小且化学性质不活泼,因此常被用来填充气球;
③由于固体氯化钙和碳酸钙的 _____不同,所以可以用水加以区分;
④我们可以根据酒精、白醋和水的 _____ 明显不同来区分它们.
(2)根据用途,选择相应的仪器,将它们的序号字母填在相应位置.
A.试管 B.烧杯 C.坩埚钳 D.铁架台 E.胶头滴管
①在做镁条燃烧实验时,用于夹持镁条的仪器是 ______ ;
②溶解较多量的固体用到的容器是 ____ ;
③可以直接在酒精灯火焰上加热的玻璃仪器是 ____ ;
④取用少量液体药品的仪器是 ____.
(3)按下图配方可配制一瓶清凉甘甜的汽水. 根据图中信息回答:
①小苏打中含有的金属元素的名称是 ____ ;
②汽水中含量最多的物质的化学式是 ____ ;
③打开瓶盖产生气体,说明气体溶解度与 ______ 有关;
④配制汽水时发生反应的化学方程式为:3NaHCO3+H3R=Na3R+3H2O+3X↑,则X的化学式是 ______;
⑤白糖的主要成分是C12H22O11,其中碳、氢两种元素的质量比是 _______ .

在生产生活中,你会发现“化学就在身边”.
(1)将下列各名词的序号填在与之相对应的空格中.
a.乳化 b.密度 c.气味 d.颜色 e.溶解性
①用洗洁精洗涤有油污的碗筷,是因为洗洁精具有______作用;
②由于氦气的______小且化学性质不活泼,因此常被用来填充气球;
③由于固体氯化钙和碳酸钙的______不同,所以可以用水加以区分;
④我们可以根据酒精、白醋和水的______明显不同来区分它们.
(2)根据用途,选择相应的仪器,将它们的序号字母填在相应位置.
A.试管 B.烧杯 C.坩埚钳 D.铁架台 E.胶头滴管
①在做镁条燃烧实验时,用于夹持镁条的仪器是______;
②溶解较多量的固体用到的容器是______;
③可以直接在酒精灯火焰上加热的玻璃仪器是______;
④取用少量液体药品的仪器是______.
(3)按右图配方可配制一瓶清凉甘甜的汽水. 根据图中信息回答:
①小苏打中含有的金属元素的名称是______;
②汽水中含量最多的物质的化学式是______;
③打开瓶盖产生气体,说明气体溶解度与______有关;
④配制汽水时发生反应的化学方程式为:3NaHCO3+H3R═Na3R+3H2O+3X↑,则X的化学式是______;
⑤白糖的主要成分是C12H22O11,其中碳、氢两种元素的质量比是______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)将下列各名词的序号填在与之相对应的空格中.
a.乳化 b.密度 c.气味 d.颜色 e.溶解性
①用洗洁精洗涤有油污的碗筷,是因为洗洁精具有______作用;
②由于氦气的______小且化学性质不活泼,因此常被用来填充气球;
③由于固体氯化钙和碳酸钙的______不同,所以可以用水加以区分;
④我们可以根据酒精、白醋和水的______明显不同来区分它们.
(2)根据用途,选择相应的仪器,将它们的序号字母填在相应位置.
A.试管 B.烧杯 C.坩埚钳 D.铁架台 E.胶头滴管
①在做镁条燃烧实验时,用于夹持镁条的仪器是______;
②溶解较多量的固体用到的容器是______;
③可以直接在酒精灯火焰上加热的玻璃仪器是______;
④取用少量液体药品的仪器是______.
(3)按右图配方可配制一瓶清凉甘甜的汽水. 根据图中信息回答:
①小苏打中含有的金属元素的名称是______;
②汽水中含量最多的物质的化学式是______;
③打开瓶盖产生气体,说明气体溶解度与______有关;
④配制汽水时发生反应的化学方程式为:3NaHCO3+H3R═Na3R+3H2O+3X↑,则X的化学式是______;
⑤白糖的主要成分是C12H22O11,其中碳、氢两种元素的质量比是______.
 查看习题详情和答案>>
查看习题详情和答案>>
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是
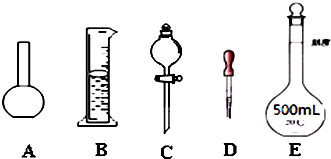
(2)下列操作中,容量瓶所不具备的功能有
A、配制一定体积准确浓度的标准溶液
B、贮存溶液
C、测量容量瓶规格以下的任意体积的液体
D、准确稀释某一浓度的溶液
E、用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
查看习题详情和答案>>
(1)如图所示的仪器中配制溶液肯定不需要的是
ABC
ABC
(填序号),配制上述溶液还需用到的玻璃仪器是玻璃棒、烧杯
玻璃棒、烧杯
(填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有
BCE
BCE
(填序号).A、配制一定体积准确浓度的标准溶液
B、贮存溶液
C、测量容量瓶规格以下的任意体积的液体
D、准确稀释某一浓度的溶液
E、用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
2.0
2.0
g.在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度小于
小于
0.1mol/L(填“大于”、“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于
小于
0.1mol/L.(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
13.6
13.6
mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用15
15
mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
.空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J 查看习题详情和答案>>