摘要:成语被誉为中华民族语言的瑰宝.下列成语中.其本意主要指化学变化的是 A 铁杵磨成针 B死灰复燃 C 木已成舟 D积土成山
网址:http://m.1010jiajiao.com/timu3_id_271857[举报]
信息、能源和材料被誉为当代文明的三大支柱,请回答下列问题:
(1)人类最早使用的合金材料是 (填字母,下同),目前使用量最大的合金是 .
A.铁合金 B.铝合金 C.铜合金
(2)金属的腐蚀现象非常普遍,钢铁腐蚀属于电化学腐蚀,形成原电池的负极反应式是 .下列方法不利于延缓铁制品的腐蚀速度的是 (填字母).
A.表面刷油或涂漆B.表面镀锌 C.保存在潮湿环境中
D.包上塑料层E.制成不锈钢F.保存在温度较高的地方
(3)通常所说的三大材料是指金属材料、无机非金属材料和有机高分子材料.下述材料中全部属于金属材料的有 (填字母,下同),全部属于有机高分子材料的有 .
A.玻璃、陶瓷、水泥 B.玻璃钢、聚乙烯、超导陶瓷
C.青铜、碳素钢、硬铝 D.塑料、合成纤维、橡胶
(4)下列物质中不是制玻璃所需要的原料是 (填字母).
A.纯碱 B.黏土 C.石灰石 D.石英. 查看习题详情和答案>>
(1)人类最早使用的合金材料是
A.铁合金 B.铝合金 C.铜合金
(2)金属的腐蚀现象非常普遍,钢铁腐蚀属于电化学腐蚀,形成原电池的负极反应式是
A.表面刷油或涂漆B.表面镀锌 C.保存在潮湿环境中
D.包上塑料层E.制成不锈钢F.保存在温度较高的地方
(3)通常所说的三大材料是指金属材料、无机非金属材料和有机高分子材料.下述材料中全部属于金属材料的有
A.玻璃、陶瓷、水泥 B.玻璃钢、聚乙烯、超导陶瓷
C.青铜、碳素钢、硬铝 D.塑料、合成纤维、橡胶
(4)下列物质中不是制玻璃所需要的原料是
A.纯碱 B.黏土 C.石灰石 D.石英. 查看习题详情和答案>>
(2012?焦作一模)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
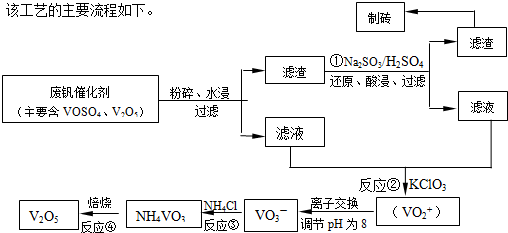
请回答下列问题:
(1)23V在元素周期表位于第
(2)反应①的目的是
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式
(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变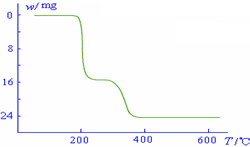 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
查看习题详情和答案>>
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)23V在元素周期表位于第
四
四
周期VB
VB
族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为3V2O5+10Al
6V+5Al2O3
| ||
3V2O5+10Al
6V+5Al2O3
.
| ||
(2)反应①的目的是
将V2O5转化为可溶性的VOSO4
将V2O5转化为可溶性的VOSO4
.(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式
NH4++VO3-=NH4VO3↓
NH4++VO3-=NH4VO3↓
.(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
2
2
VO2++1
1
H2C2O4+2
2
H+→2
2
VO2++2
2
CO2+2H2O
2H2O
.(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变
 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中B
B
.A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示.有关该化合物的叙述正确的是( )
查看习题详情和答案>>
被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2+ C+ Cl2═ TiCl4+ CO
(1)配平上述反应的化学方程式并用双线桥法标出电子转移;
(2)指出该反应的氧化剂 ,氧化产物 ;
(3)当有6mol电子转移,则有 mol还原剂被氧化.
查看习题详情和答案>>
(1)配平上述反应的化学方程式并用双线桥法标出电子转移;
(2)指出该反应的氧化剂
(3)当有6mol电子转移,则有
锂在原子能工业中占有十分独特的地位,被誉为“高能金属”.它推动着能源工业,尤其是电池技术的发展,无愧于“能源金属”和“推动世界前进的金属”的称号.
Ⅰ.探究金属锂的制备
工业上用硫酸与β-锂辉矿(LiAlSi206和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,请回答下列问题:
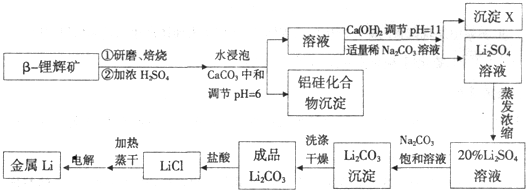
(1)LiAlSi206的组成用氧化物的形式表示为 ;
(2)沉淀X的主要成分是(写化学式) ;
(3)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体.试写出氢化锂遇水反应的化学方程式: ;
(4)将盐酸与Li2CO3,完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂.电解时产生的氯气中会混有少量氧气,原因是 .
Ⅱ探究金属锂的应用
(5)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2电池的总反应为:4Li+2SOCl2═4LiCl+S+SO2↑.请回答下列问题:
①电池的正极上发生的电极反应为 ;
(6)实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,实验现象是出现白雾,有刺激性气味的气体生成,反应的化学方程式为 .
查看习题详情和答案>>
Ⅰ.探究金属锂的制备
工业上用硫酸与β-锂辉矿(LiAlSi206和少量钙镁杂质)在250~300℃反应,生成Li2SO4以及硅铝化合物、MgSO4等,请回答下列问题:

(1)LiAlSi206的组成用氧化物的形式表示为
(2)沉淀X的主要成分是(写化学式)
(3)锂和氢气在加热时能反应生成白色固体氢化锂,氢化锂遇到水就立即溶解并释放出大量的气体.试写出氢化锂遇水反应的化学方程式:
(4)将盐酸与Li2CO3,完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂.电解时产生的氯气中会混有少量氧气,原因是
Ⅱ探究金属锂的应用
(5)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2电池的总反应为:4Li+2SOCl2═4LiCl+S+SO2↑.请回答下列问题:
①电池的正极上发生的电极反应为
(6)实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,实验现象是出现白雾,有刺激性气味的气体生成,反应的化学方程式为