摘要:1.知道溶质的质量分数是是溶质的质量与溶液的质量之比. 2.能进行有关溶质质量分数的简单计算. 3.初步学会配制一定溶质质量分数的溶液. 二.命题落点 1.以选择.填空等形式来考查有关溶质质量分数的简单计算.如例1. 2.联系生活实际.考查溶液知识及其有关计算.如例2. 3.分析.判断不同“溶质 溶于水时所引起的溶质质量分数的变化情况.如例3. 4.依据公式进行溶液配制实验误差的分析.如例4. [典例精析] 例1.将一瓶80g 溶质质量分数为10%的NaCl溶液平均分为2等份.每份溶液中溶质的质量分数为 ,若将其中的一份溶液中溶质的质量分数减小一半.应加水 g.若将另一份溶液中溶质的质量分数增大一倍.应加入NaCl g. 解析:根据溶液的均一性可知.无论将原来的溶液怎么样来分.只要条件不改变.其溶质的质量分数是不会发生变化的.增加溶剂的质量能使溶质的质量变小.加入多少水才能使40g10%的NaCl溶液的溶质质量分数减小一半呢?显然.所加水的质量应该和对应溶液的质量一样多(40g),通过加入溶质的方法肯定能使溶液中溶质的质量分数增大.那么.所加入的溶质质量怎样计算呢?很简单:依据溶质质量分数的计算公式.但要注意.加入这部分溶质后.不仅能使溶质的质量增大.同样也使溶液的质量增大.若设加入的溶质质量为x.则由题意可得: =20% 解之.x=5g. 答案:10%,40,5 . 例2.日常生活中我们要科学地节约用水.现有一件刚用洗涤剂洗过的衣服.“拧干 后湿衣服上残留的溶液为100g.其中洗涤剂的质量分数为1%.则湿衣服上残留的洗涤剂质量为 g.现用5700g清水对这件衣服进行漂洗.有以下两种漂洗方法(假设每次“拧干 后湿衣服仍残留100g溶液): 方法一:用5700g清水漂洗."拧干"后残留在衣服上的洗涤剂质量为 g, 方法二:用5700g清水均匀分成质量相等的三份.分三次漂洗: 第1次.用1900g清水漂洗.“拧干 后残留在衣服上的洗涤剂质量为 g, 第2次.用1900g清水漂洗.“拧干 后残留在衣服上的洗涤剂质量为 g, 第3次.用1900g清水漂洗.“拧干 后残留在衣服上的洗涤剂质量为 g. 由以上计算分析.用相同质量的水漂洗衣服.是一次漂洗效果好.还是将水分成三份.分三次漂洗效果好? 解析:这是一道密切联系生活实际的简单计算题.试题旨在通过简单计算.使大家明白并掌握节约用水的一种方法.通过这种方法的介绍.引导我们进一步树立节约水.爱惜水的观念.做到合理地利用水.科学地节约和保护水.其实.该题的实质是关于溶质溶解.溶液稀释的计算.它以日常生活中的小事为背景.将漂洗衣服时为什么要“少量多次 的科学道理让学生通过计算加以感受.既考查了分析与计算能力.又进行了节约用水的方法教育.真可谓“匠心独具 .是一道难得的好题. 解答时要注意:题中“拧干后湿衣服上残留的溶液仍为100g .这就意味着不论用什么方法.进行哪一次漂洗.这“100g溶液 始终应跟随在计算的过程中.如用方法2进行第一次漂洗.漂洗时所用“水 的总质量就应当是:1900g+100g=2000g.“拧干 后残留在衣服上的洗涤剂质量的质量分数为:100g×1%÷2000g=0.05%.因此.残留在衣服上的洗涤剂的质量为:0.05%×100g=1/20 g. 例3.在t ℃时.将 10 g某纯净物完全溶解在90 g水中.你认为所得溶液中溶质的质量分数可能出现哪些情况?试举例说明. 解析 :解答此题.既要掌握溶质质量分数的计算公式.又要熟悉物质溶于水的三种情况:①物质溶解于水后.溶质本身没变.像氯化钠.硝酸钠等.溶质的质量为 10 g.溶质的质量分数:×100%=10%. ②物质溶于水时.与部分水发生化合反应.溶质不再是加入的物质.而是化合后生成的新物质.这时其质量肯定大于 10 g.因此所得溶液中溶质的质量分数也一定大于 10%.如三氧化硫溶于水就是这种情况. ③结晶水合物溶于水时.结晶水转化为溶剂水.这样一来.溶液中溶质的质量小于 10 g.而溶剂质量却大于90 g.因此.溶质的质量分数必定小于 10%.如兰矾(CuSO4·5H2O)溶于水就是这种情况. 例4.配制10%的氯化钠溶液时.不会引起溶液中氯化钠的质量分数偏小的是( ) A.用量筒量取水时仰视读数 B.配制溶液的烧杯用少量蒸馏水润洗 C.氯化钠晶体不纯 D.转移已配好的溶液时.有少量溶液溅出 解析:配制一定溶质质量分数的溶液是一个定量实验.所用试剂不当或操作错误都会给实验结果带来一定的影响.影响的结果如何.我们是可以通过溶质质量分数的计算公式来作出判断的.对于A.这样量取的水的体积要比理论上的体积大一些.其质量也相应变大.因此配得的溶液中氯化钠的质量分数将偏小,对于B.此时相当于所用水的质量增大了.会引起溶液中氯化钠的质量分数偏小,当氯化钠晶体不纯时.相当于溶质的质量减小.这样就会引起溶液中氯化钠的质量分数偏小,在将溶液配制完成之后.即便有少量溶液溅出.但不会影响其中氯化钠的质量分数. 答案:D. [常见误区] 1.认为只要加入溶质就能使溶液中溶质的质量分数变大.仔细想一想.如果溶液本来就是某一定温度下的饱和溶液.再加入溶质后还能继续溶解吗?此时溶质的质量分数还会变大吗?答案是显而易见的. 2.在计算加入溶质所得溶液的质量分数时.只看到溶质质量的增加.未想到溶液的质量也同样增加.从而导致计算结果的错误. 3.不能全面考虑物质溶于水时所发生的变化.认为加入水中的物质都是溶质.生搬硬套公式进行计算.如例3. 4.分析配制一定溶质质量分数的溶液所可能造成的误差时.找不准正确的判断依据.只凭主观想像加以判断.如例4. [基础演练]1.对于溶液的有关叙述.正确的是( ) A.在两种溶液中.含溶质较多的.其溶质的质量分数就大 B.在一定量的溶液中.再加入一些溶剂后.其溶质的质量分数就变小 C.将50℃时的硝酸钾的饱和溶液降温.有可能变成不饱和溶液 D.一切溶液中的溶剂都是水
网址:http://m.1010jiajiao.com/timu3_id_27144[举报]
体积分数为75%的酒精溶液常用于灭菌消毒,此浓度杀菌力最强.在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用.低于这个浓度,其渗透脱水作用减弱,杀菌力不强;而高于此浓度,则会使细菌表面蛋白质迅速脱水,凝固成膜,妨碍乙醇透入,削弱杀菌能力.乙醇杀菌力强,但对病毒无效,故不能预防肝炎等病毒性疾病.
(1)乙醇还常用作酒精灯、火锅、内燃机的燃料,乙醇在空气中完全燃烧的化学方程式为
(2)白酒、红酒和啤酒中均含有乙醇,饮酒后酒精可进入人体血液中,青少年正处于身体发育阶段,绝对不能酗酒.今年5月1日起,《中华人民共和国刑法修正案(八)》开始实施,醉驾与飙车行为入刑定罪.另外,修改后的道路交通安全法规定,醉酒驾驶机动车辆将一律吊销驾照,并在五年内不得重新取得.醉酒驾驶营运机动车的,十年内不得重新取得机动车驾驶证,重新取得机动车驾驶证后,不得驾驶营运机动车.对饮酒后驾驶机动车的,罚款1000元以上2000元以下,暂扣机动车驾驶证6个月;因饮酒后驾驶机动车被处罚后,再次饮酒后驾驶机动车的,处10日拘留和2000元罚款,并处吊销机动车驾驶证.
请阅读国家对“饮酒驾车”和“醉酒驾车”的界定标准并回答下列问题:
交警查酒驾通常会用到“酒精检测仪”.目前使用的酒精探测仪有两类:
①是定性检测人呼出的气体中是否含有酒精成分.可利用乙醇分子可以使
②是定量测量人呼出的气体中酒精的含量.据有关研究表明:人体肺部的酒精气体浓度与血液中的酒精含量存在着良好的线性关系,大致比例关系为1:2200;已知饮用某啤酒1大杯(0.56L),会使血液中乙醇含量升高30mg/100mL,某驾驶员饮用了3大杯上述啤酒后驾车,其体内每100mL血液中乙醇的含量(理论上)升高了
查看习题详情和答案>>
(1)乙醇还常用作酒精灯、火锅、内燃机的燃料,乙醇在空气中完全燃烧的化学方程式为
C2H5OH+3O2
2CO2+3H2O
| ||
C2H5OH+3O2
2CO2+3H2O
.乙醇中碳、氢、氧元素的质量比是C﹕H﹕O=
| ||
12:3:8
12:3:8
;(2)白酒、红酒和啤酒中均含有乙醇,饮酒后酒精可进入人体血液中,青少年正处于身体发育阶段,绝对不能酗酒.今年5月1日起,《中华人民共和国刑法修正案(八)》开始实施,醉驾与飙车行为入刑定罪.另外,修改后的道路交通安全法规定,醉酒驾驶机动车辆将一律吊销驾照,并在五年内不得重新取得.醉酒驾驶营运机动车的,十年内不得重新取得机动车驾驶证,重新取得机动车驾驶证后,不得驾驶营运机动车.对饮酒后驾驶机动车的,罚款1000元以上2000元以下,暂扣机动车驾驶证6个月;因饮酒后驾驶机动车被处罚后,再次饮酒后驾驶机动车的,处10日拘留和2000元罚款,并处吊销机动车驾驶证.
请阅读国家对“饮酒驾车”和“醉酒驾车”的界定标准并回答下列问题:
| 饮酒驾车 | 20mg/100mL≤血液中的酒精含量≤80mg/100mL |
| 醉酒驾车 | 血液中的酒精含量≥80mg/100mL |
①是定性检测人呼出的气体中是否含有酒精成分.可利用乙醇分子可以使
橙红
橙红
色的重铬酸钾(K2Cr2O7,课本上有其晶体照片)在酸性溶液中变为绿色的硫酸铬Cr2(SO4)3,化学方程式为:2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O,铬元素的化合价由高到低依次为+6
+6
、+3
+3
.②是定量测量人呼出的气体中酒精的含量.据有关研究表明:人体肺部的酒精气体浓度与血液中的酒精含量存在着良好的线性关系,大致比例关系为1:2200;已知饮用某啤酒1大杯(0.56L),会使血液中乙醇含量升高30mg/100mL,某驾驶员饮用了3大杯上述啤酒后驾车,其体内每100mL血液中乙醇的含量(理论上)升高了
90
90
mg,交警发现后,通过采样其口中呼出的气体,检测出酒精浓度为0.4227mg/L,则该驾驶员属于醉酒
醉酒
驾车(填“正常”或“饮酒”或“醉酒”).
学习了溶液的概念后,老师的提问及同学的回答如图所示:

(1)以上三位同学中能够正确描述溶液特征的是 同学.
老师接着问:“你们还想知道什么?”
王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).
(3)该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,A物质的饱和溶液溶质质量分数大于B物质的饱和溶液溶质质量分数,该温度范围是 .
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量A B(填“大于”、“等于”或“小于”).
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是
g.
查看习题详情和答案>>

(1)以上三位同学中能够正确描述溶液特征的是
老师接着问:“你们还想知道什么?”
王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).

| 温度/゜C | 0 | 20 | 40 | 60 | |
| 溶解度/g | A物质 | 30 | 35 | 41 | 50 |
| B物质 | 25 | 35 | 55 | 90 | |
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量A
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是
钢铁是重要的金属材料,在生产、生活中有广泛的用途.
(1)钢铁属于 (填“纯净物”或“混合物”).
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失.在日常生活中,小明发现切过咸菜的菜刀更容易生锈.为了验证该现象,小明做了下列实验:
取两支试管,分别放上一个相同铁钉,在一支试管中加入 ,在另一支试管中加入等体积的 ,一周后小明观察实验现象,得到了与日常生活中相同的结果,他的结论是:水中溶有 .
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法.这些方法都能防止锈蚀的共同原理是 .
(4)铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为:
;
一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式:
;
长时间反应后,溶液中有黑色颗粒沉淀,该物质是 ,把该物质从溶液中分离出来的方法是 .
(5)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
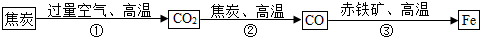
请写出第③步反应的化学方程式: ;
(6)金属矿物的储量有限,而且不能再生,所以废钢铁要 .
(7)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应.
请写出铜在空气中生成铜绿的化学方程式 .
(8)将盛有等质量、等质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铝和铁(提示:铝与盐酸反应生成氯化铝和氢气),待反应停止后,请判断:
若天平仍保持平衡,烧杯中一定没有剩余的物质是 ;
若天平失去平衡,则指针一定偏向 的一侧.
查看习题详情和答案>>
(1)钢铁属于
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失.在日常生活中,小明发现切过咸菜的菜刀更容易生锈.为了验证该现象,小明做了下列实验:
取两支试管,分别放上一个相同铁钉,在一支试管中加入
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法.这些方法都能防止锈蚀的共同原理是
(4)铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为:
一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式:
长时间反应后,溶液中有黑色颗粒沉淀,该物质是
(5)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
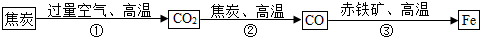
请写出第③步反应的化学方程式:
(6)金属矿物的储量有限,而且不能再生,所以废钢铁要
(7)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu2(OH)2CO3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO2参加反应.
请写出铜在空气中生成铜绿的化学方程式
(8)将盛有等质量、等质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铝和铁(提示:铝与盐酸反应生成氯化铝和氢气),待反应停止后,请判断:
若天平仍保持平衡,烧杯中一定没有剩余的物质是
若天平失去平衡,则指针一定偏向
学习了溶液的概念后,老师的提问及同学的回答如图所示:
(1)以上三位同学中能够正确描述溶液特征的是
老师接着问:“你们还想知道什么?”
王华回答:“影响物质在水中溶解能力 的因素有哪些?”
(2)表列出了从探究实验中获取的部分数据,
该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,A物质的饱和溶液溶质质量分数大于B物质的饱和溶液溶质质量分数,温度范围是
(3)将在20℃时等量的A、B饱和溶液同时降温到10℃,则析出晶体的质量A
(4)在20℃时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是
查看习题详情和答案>>

(1)以上三位同学中能够正确描述溶液特征的是
李佳王华
李佳王华
同学.老师接着问:“你们还想知道什么?”
王华回答:“影响物质在水中溶解能力 的因素有哪些?”
(2)表列出了从探究实验中获取的部分数据,
该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,A物质的饱和溶液溶质质量分数大于B物质的饱和溶液溶质质量分数,温度范围是
0℃-20℃(不包括20℃)
0℃-20℃(不包括20℃)
.| 温度/゜C | 0 | 20 | 40 | 60 | |
| 溶解度/g | A物质 | 30 | 35 | 41 | 50 |
| B物质 | 25 | 35 | 55 | 90 | |
小于
小于
B(填“大于”、“等于”或“小于”).(4)在20℃时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是
135
135
g.学习了溶液的概念后,老师的提问及同学的回答如下:
老师问:对于溶液,大家已经知道了什么?
王华回答:溶液是一种混合物;
李佳回答:溶液中各部分密度相同;
张军回答:溶液是无色透明的.
(1)以上三位同学中,对于溶液描述正确的是
王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在如图的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B);


(3)若要从B的饱和溶液中得到大量B物质,则一般可以采用
(4)在
(5)在0℃时,100克B的饱和溶液中含B
查看习题详情和答案>>
老师问:对于溶液,大家已经知道了什么?
王华回答:溶液是一种混合物;
李佳回答:溶液中各部分密度相同;
张军回答:溶液是无色透明的.
(1)以上三位同学中,对于溶液描述正确的是
王华和李佳
王华和李佳
同学;老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在如图的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B);


(3)若要从B的饱和溶液中得到大量B物质,则一般可以采用
冷却结晶
冷却结晶
方法;(4)在
20
20
℃时,分别配制A、B两种物质的等质量的饱和溶液,需要用水的质量相等;(5)在0℃时,100克B的饱和溶液中含B
25
25
克.