网址:http://m.1010jiajiao.com/timu3_id_270596[举报]
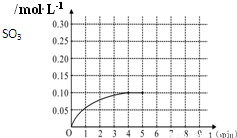
 一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:(1)达到平衡时该反应放出的能量为
(2)该条件下,反应的化学平衡常数K=
(3)下列有关说法正确的是
a.容器中SO3的百分含量保持不变和混合气体的密度保持不变都可以说明反应达到平衡
b.使用催化剂不能提高SO2的转化率,但可以提高SO3的产量
c.若恒温恒压,向容器中充入Ar,SO2的转化率减小
d.向原平衡体系中再充入一定量的O2,平衡正向移动,则SO3的体积分数一定增大
e.向容器再充入0.4mol SO2和0.2molO2,则达到平衡时c(SO3)>0.2mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则SO3的物质的量浓度不可能为
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),请在图中画出第5分钟末达到此平衡时SO3浓度的变化曲线.
(1)达到平衡时该反应放出的能量为______kJ,若将题给条件改为恒温恒压,则达到平衡时放出的能量将______(填“增多”、“减少”或“不变”).
(2)该条件下,反应的化学平衡常数K=______.
(3)下列有关说法正确的是______.
a.容器中SO3的百分含量保持不变和混合气体的密度保持不变都可以说明反应达到平衡
b.使用催化剂不能提高SO2的转化率,但可以提高SO3的产量
c.若恒温恒压,向容器中充入Ar,SO2的转化率减小
d.向原平衡体系中再充入一定量的O2,平衡正向移动,则SO3的体积分数一定增大
e.向容器再充入0.4mol SO2和0.2molO2,则达到平衡时c(SO3)>0.2mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则SO3的物质的量浓度不可能为______.
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),请在图中画出第5分钟末达到此平衡时SO3浓度的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
查看习题详情和答案>>
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。

下列叙述正确的是
A.做该实验时环境温度为22 ℃ B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L D.该实验表明有水生成的反应都是放热反应
(3)V1=30mL时HCl和NaOH恰好反应,根据题中所给数据算出的温度变化值约为
(保留整数,计算时可将稀溶液的密度及比热容看成与水近似相同,且溶液混合时体积变化忽略不计);而根据上图的温度变化可读出温度变化值约7 ℃;两者相比所测结果偏低,造成如此现象的原因有:
查看习题详情和答案>>
 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为