网址:http://m.1010jiajiao.com/timu3_id_267627[举报]
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在①、③的反应中均被还原
C.氧化性由强到弱的顺序是:XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是:Z-、B-、A2+、X2+ 查看习题详情和答案>>
(14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是 。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4 = NaHSO4 + HBr
② .;
(3)冷水的作用 ;d试管中的现象 ,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
查看习题详情和答案>>
(14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是 。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4= NaHSO4 + HBr
② .;
(3)冷水的作用 ;d试管中的现象 ,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂 
(14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是 。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4 = NaHSO4 + HBr
② .;
(3)冷水的作用 ;d试管中的现象 ,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液 B.NaOH溶液 C.Na2SO3溶液 D.KCl溶液
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂

查看习题详情和答案>>
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):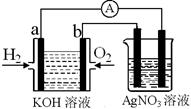
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向正极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。 查看习题详情和答案>>