网址:http://m.1010jiajiao.com/timu3_id_266823[举报]
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液
②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp
(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为
(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数
| b |
| a-b |
| b |
| a-b |
(1)NaHA溶液
(2)某温度下,向0.1mol?L-1的NaHA溶液中滴入0.1mol?L-1KOH溶液至中性,此时溶液中以下关系一定正确的是
A.c(H+)?c(OH-)=1×10-14 mol2?L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol?L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq);△H>0.
①温度升高时,Ksp
②滴加少量浓盐酸,c(Ca2+)
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式
(10分)已知H2A在水中存在以下平衡:H2A H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是_____________________________ ___。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2·L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c (Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)  Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-??H++A2-。
(1)常温下NaHA溶液的pH________(填序号),原因是_________________。
A.大于7 B.小于7
C.等于7? D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)??Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度?????????????????? B.降低温度
C.加入NH4Cl晶体??????????? D.加入Na2A固体
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
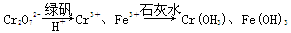
(1)该废水中加入绿矾和H+,发生反应的离子方程式为____________________。
(2)若处理后的废水中残留的c(Fe3+)=2.0×10-13 mol·L-1,则残留的Cr3+的浓度为________。
(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
查看习题详情和答案>>
(12分)弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液的pH (填大于、小于或等于) Na2A溶液的pH。
⑵某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq)
△H>0。
Ca2+(aq)+A2-(aq)
△H>0。
①降低温度时,Ksp (填“增大”、“减小”或“不变”)。
②滴加少量浓盐酸,c(Ca2+) (填“增大”、“减小”或“不变”)。
II、含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,作如下处理:

(1)该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为: 。
(2)欲使10L该废水中的Cr2O72-完全转化为Cr3+,理论上需要加入 g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe3+)=2×10-13mol·L-1,则残留的Cr3+的浓度为 。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
查看习题详情和答案>>