摘要: Ⅰ:已知PCl5是一种白色晶体.加热到160℃时可不经过液态阶段就直接变成了蒸气.测知180℃时的蒸气密度为9.3g/L .分子没有极型.P-Cl键长为204pm和211pm两种.若继续加热到250℃时.测知压强为计算值的2倍.已知PCl5在加压下于148℃液化.形成一种能够导电的熔体.测知此时P-Cl键长为198pm和206pm两种.请回答下列问题: ⑴180℃时的PCl5蒸气中存在的分子的化学式为 . ⑵250℃时的PCl5蒸气中存在的分子的化学式为 . ⑶PCl5熔体能导电.其原因是 . ⑷PBr5气态分子的结构与PCl5相似.它的熔体也能导电.经测定.得知其中只存在一种P-Br键长.PBr5熔体能导电.其原因是 . Ⅱ:分析化学中常用X射线研究晶体结构.用X射线研究某种蓝色晶体.发现该晶体的重复结构中所含的Fe2+.Fe3+.CN-的分布如图所示.请推断: ⑴由图中Fe2+.Fe3+.CN-所构成粒子的化学式是 .(化学式应将Fe2+.Fe3+.CN-约简到最简整数比) ⑵用 离子(填“M+ 或“M- )与其结合呈电中性.
网址:http://m.1010jiajiao.com/timu3_id_266313[举报]
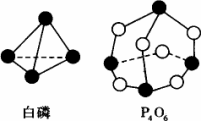
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O-O:498计算反应P4(白磷)+3O2→P4O6的反应热为________.
PCl5也是一种白色固体,加热到160℃不经过液态阶段就变为蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3 g·L-1,继续加热到250℃时测得压力为计算值的两倍.PCl5在加压下于148℃液化,形成一种能导电的液体,测得P-Cl的键长为198 pm和206 pm两种.根据以上条件回答下列问题:
(1)PCl5固体是一种什么类型的晶体?180℃下PCl5蒸气中存在什么分子?为什么?
(2)250℃下PCl5蒸气中存在什么分子?为什么?
(3)PCl5熔体为什么导电?用最简洁的形式作出解释?