摘要:6.在20℃时.某反应速率为0.1mol/.若该反应温度每升高10℃反应速率增加到原来的3倍.则40℃时其反应速率为: A.0.6mol/ C.1mol/
网址:http://m.1010jiajiao.com/timu3_id_265507[举报]
在某2L的密闭容器中加入0.1mol碘单质和足量钨(W),在943K时,发生反应W(s)+I2(g)?WI2(g),当I2的转化率为20%时,达化学平衡状态.
(1)反应从开始至平衡状态过程中用时20s,其平均反应速率v(WI2)为
(2)943K时,该反应的平衡常数K=
(3)若起始时,加入的碘为0.2mol(其他条件不变)达平衡时容器中气体的体积比V(I2):V(WI2)=
(4)在上述(1)平衡状态下,同时增加I2(g)和WI2(g)各0.02mol(其他条件不变),化学平衡向
查看习题详情和答案>>
(1)反应从开始至平衡状态过程中用时20s,其平均反应速率v(WI2)为
5×10-4mol?L-1?s-1
5×10-4mol?L-1?s-1
.(2)943K时,该反应的平衡常数K=
0.25
0.25
.(3)若起始时,加入的碘为0.2mol(其他条件不变)达平衡时容器中气体的体积比V(I2):V(WI2)=
4:1
4:1
.(4)在上述(1)平衡状态下,同时增加I2(g)和WI2(g)各0.02mol(其他条件不变),化学平衡向
逆反应
逆反应
(填“正反应”或“逆反应”)方向移动,判断的依据是Qc=0.4>K=0.25
Qc=0.4>K=0.25
.
常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是 .加入四氯化碳的作用是 .
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是 ;乙同学结合平衡移动的知识,认为还有一个原因是 .
(3)该反应的平衡常数表达式为 .
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
分析表中数据,I-浓度对反应速率的影响 Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”),理由是(写出计算过程) .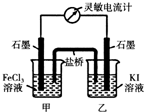
(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是 (填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时 (填“甲“或“乙”)中石墨电极为负极,对应的电极反应方程式为 .
查看习题详情和答案>>
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)该反应的平衡常数表达式为
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |

(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为: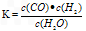
(1)写出该反应的化学方程式:___________;
(2)能判断该反应一定达到化学平衡状态的依据是__________ (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中气体的总物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=_____________。
(2)若继续加入2 mol Fe(s),则平衡____________移动。
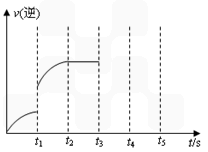
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是_____________ 。(填写2项)
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
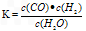
(1)写出该反应的化学方程式:___________;
(2)能判断该反应一定达到化学平衡状态的依据是__________ (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中气体的总物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=_____________。
(2)若继续加入2 mol Fe(s),则平衡____________移动。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是_____________ 。(填写2项)
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式:____________________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=____________。
(2)若继续加入2 mol Fe(s),则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是____________、____________。(填写2项)
(Ⅰ)若某可逆反应的化学平衡常数表达式为:

(1)写出该反应的化学方程式:____________________;
(2)能判断该反应一定达到化学平衡状态的依据是____________(填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化
D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1)t1~t2这段时间内的化学反应速率v(H2)=____________。
(2)若继续加入2 mol Fe(s),则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是____________、____________。(填写2项)

一定温度下在体积为5 L的密闭容器中投入原料发生反应。
Ⅰ.若某可逆反应的化学平衡常数表达式为:![]()
写出该反应的化学方程式: ;
Ⅱ.若该密闭容器中加入的是2molFe(s)与1mol H2O(g)可以生成Fe3O4(s)与H2(g)。t1秒时,测得H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
 |
(2) 该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)
(3) 若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为
mol。
查看习题详情和答案>>