网址:http://m.1010jiajiao.com/timu3_id_264585[举报]
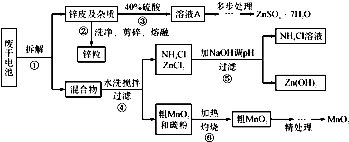
(1)操作②中所用的加热仪器应选
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+ 沉淀,请写出氨水和Fe3+反应的离子方程式:
(3)操作⑤是为了除去溶液中的Zn2+.已知25℃时,一些数据见下表:
| NH3?H2O的Kb | Zn 2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol?L-1的H2SO4的混合液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+ ).反应生成MnSO4的离子方程式为
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe 3+ 沉淀完全,再加活性炭搅拌,抽滤.加活性炭的作用是
步骤3:向滤液中滴加0.5mol?L-1的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,并在空气中灼烧至黑褐色,生成MnO2.灼烧过程中反应的化学方程式为
| ||
| ||
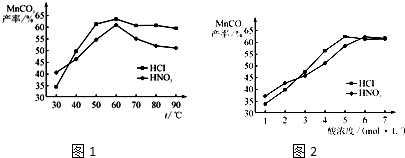
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体.
①在盐酸和硝酸溶液的浓度均为5mol?L-1、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图1,由图看出两种酸的最佳浸泡温度都在
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如图2,由图看出硝酸的最佳浓度应选择
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c (OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+ 的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B.③⑥ C.③⑤ D.②④
查看习题详情和答案>>
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c (OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+ 的溶液中: Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.③⑤ B.②④ C.①② D.③⑥
查看习题详情和答案>>
(10分)
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2 水 D. HNO3
然后再加入适当物质调整至溶液pH=3.8,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损
失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=3.8是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可
以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,
Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1
时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的
pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填
“可行”或“不可行”)。
查看习题详情和答案>>