网址:http://m.1010jiajiao.com/timu3_id_264292[举报]
| 活性炭 |
(1)试写出常温常压下化学平衡常数K的表达式:K=
| 1 |
| c(SO2)?c(Cl2) |
| 1 |
| c(SO2)?c(Cl2) |
若在此条件下,将化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是
a.缩小容器体积 b.使用催化剂 c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37Cl2,一段时间后,则平衡体系中含有37Cl的物质有
a.只有37Cl2 b.只有SO237Cl2 c.37Cl2和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应已达平衡的是
a.υ(Cl2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl2):c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(5)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g.若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是
(15分)非金属元素氮有多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是和
。实验测得N-N键键能为167kJ·mol-1,NO2中氮氧双键的平均键能为466 kJ·mol-1,N2O4中氮氧双键的平均键能为438.5 kJ·mol-1。
(1)写出NO2转化为N2O4的热化学方程式_________________________________________
(2)对反应2NO2(g) N2O4 (g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为___ __。
②2NO2(g) N2O4(g)该反应的平衡常数K的值为 ;若100℃时的某时刻测得c(NO2)=1.00mol/L,c(N2O4)=0.20mol/L,则该时刻的v正 v逆(填“>”、“<”或“=”),升高温度后,反应2NO2
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看习题详情和答案>>
[s1] (探究创新题)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、Al3+、Ag+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、NO3-、SO42- |
请根据以下实验事实逐步推出它们的名称并回答问题:
(1)
|
物质鉴定实验 |
推导结论 |
|
①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 |
A、B中含有的阴离子为________,C、D、E中含有的阳离子为______________ |
|
②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 |
A为________, C含________离子 |
|
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 |
D为________ |
(2)写出E溶液与过量的B溶液反应的离子方程式:
_______________________________________________________。
(3)在100 mL 0.1 mol/L的E溶液中,逐滴加入35 mL 2 mol/L NaOH 溶液,最终得到沉淀的物质的量为________________。
[s1]16.
查看习题详情和答案>>氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466
kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466
kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.050 |
n2 |
0.080 |
0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3
n4(填“>”、“<”或“=”),该反应的平衡常数K的值为
,升高温度后,反应2NO2 N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
查看习题详情和答案>>
氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是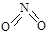 和
和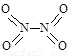 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
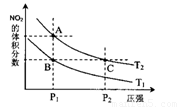
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
|
n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为
,升高温度后,反应2NO2 N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将
(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)
查看习题详情和答案>>