网址:http://m.1010jiajiao.com/timu3_id_264199[举报]
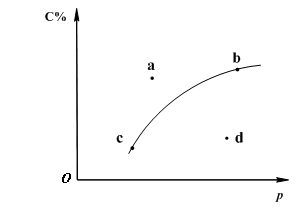
对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是 (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是 ;
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序___________;
 |
|
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率 (填“会”或“不会”)。
查看习题详情和答案>>(1)若甲是由短周期元素形成的单质,并且该元素的原子最外电子层上的电子数为其内层电子层数的二分之一,则甲元素的原子结构示意图为____________,甲与水反应的离子方程式为_________________;
(2)乙为甲的稳定的氧化物,写出乙在与水反应中氧化剂的电子式____________;19.5g乙与足量的水反应转移电子的物质的量为____________mol;
(3)丙为地壳中金属元素含量排位第二的元素形成的单质,写出它与水蒸气反应的化学方程式________________________;在实验室里,配制丙的高价氯化物溶液时要加入一定量的盐酸,解释原因并写出离子反应方程式:________________________;
(4)丁是由两种均为10个电子的微粒组成的化合物,它与碱反应能生成一种有刺激性气味的气体X,X分子中也含有10个电子,则丁属于____________类型的晶体,从综合效益角度出发,在工业上生产X时,既要增大单位时间内X产量,又要提高X的产率,可采取的措施是(填写下列合理选项的序数)
_______________。
①减压 ②加压 ③升温 ④降温 ⑤适宜的温度和压强 ⑥加催化剂
⑦及时从平衡体系中分离出X ⑧分离出X后的原料气循环使用并补充原料
一定温度时,A(g)与B(g)反应可生成C(g)。反应过程中A、B、C浓度的变化情况如图I所示。若保持其它条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图Ⅱ所示。则下列结论不正确的是
 |
A.该平衡体系的化学方程式为:A(g)+3B(g)![]() 2C(g)
2C(g)
B.(t1+10)min时,保持容积总压强不变,通入稀有气体,平衡向逆反应方向移动
C.在t1时间内使用B表示该反应的平均速率为3/5 t1mol/(L·min)
D.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看习题详情和答案>> |
A.该平衡体系的化学方程式为:A(g)+3B(g)
 2C(g)
2C(g)B.(t1+10)min时,保持容积总压强不变,通入稀有气体,平衡向逆反应方向移动
C.在t1时间内使用B表示该反应的平均速率为3/5 t1mol/(L·min)
D.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为_______________;A与甲反应在工业上一个重要用途是_______________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:_______________;丙与乙反应的化学方程式:_______________。

(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入
①若t1=10 min,则0至t1时间内C物质的平均反应速率为_______________;该反应在t2时达到平衡,其化学反应方程式为_______________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_______________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看习题详情和答案>>