摘要:27].为了测定溶液中Ba2+的浓度.做了以下实验:①称取0.1323g K2Cr2O7溶于适量的稀硫酸中.再向其中加入过量的KI溶液与之反应.反应后的溶液加入27.00mL Na2S2O3溶液时恰好反应完全.②另取50.00mLBa2+溶液.控制适当的酸度.加入足量K2CrO4的溶液.得黄色沉淀.沉淀经过滤.洗涤后.用适量稀盐酸溶解.再加入过量KI与之反应.反应后再同上述Na2S2O3溶液反应.反应完全时.消耗Na2S2O3溶液24.00mL(I2+2Na2S2O3=Na2S4O6+2NaI). (1)配平离子方程式: Cr2O72-+ I-+ H+-- Cr3++ I2+ H2O (2)黄色沉淀是 .写出盐酸溶解该沉淀的离子反应方程式 (3)预测KMnO4和K2Cr2O7酸性条件下的氧化性强弱.并用本题有关的理由说明. (4)上述两步可用 作指示剂.其现象 . (5)试计算溶液中Ba2+的物质的量浓度
网址:http://m.1010jiajiao.com/timu3_id_263991[举报]
为了测定溶液中HCl和NaCl的含量,进行如下实验:称取10g溶液恰好和8g 10%的氢氧化钠溶液中和;再向此中性溶液中加入足量硝酸银溶液,生成5.74g沉淀.求原溶液中HCl、NaCl的质量分数.
查看习题详情和答案>>(1)ag铁粉放入含bmolHNO3的浓硝酸中,加热充分反应后,再加入稀硫酸,铁粉恰好完全溶解,经测定溶液中只含Fe3+(一种金属离子)和SO42-(一种酸根离子).
①写出反应开始时溶液中发生反应的化学方程式
②写出加入硫酸后,所发生反应的离子方程式
(2)硫酸是基础化学工业的重要产品目前,我国采用“接触法”制硫酸,简单流程如图所示: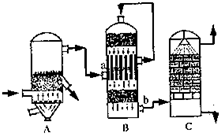
①设备B中名称是
②设备C中用98.3%的H2SO4来吸收SO2的原因是
③燃烧1t含硫质量分数为48%的黄铁矿石,在理论上能生产98%H2SO4
查看习题详情和答案>>
①写出反应开始时溶液中发生反应的化学方程式
Fe+4HNO3(浓)
Fe(NO3)2+2NO2↑+2H2O
| ||
Fe+4HNO3(浓)
Fe(NO3)2+2NO2↑+2H2O
.
| ||
②写出加入硫酸后,所发生反应的离子方程式
Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O
Fe+4H++NO3-═Fe3++NO↑+2 H2O; 3Fe2++4H++NO3-═3Fe3++NO↑+2 H2O
.(2)硫酸是基础化学工业的重要产品目前,我国采用“接触法”制硫酸,简单流程如图所示:

①设备B中名称是
接触室
接触室
,图中b处导出气体的成分是(写化学式)SO3、SO2、O2、N2
SO3、SO2、O2、N2
.②设备C中用98.3%的H2SO4来吸收SO2的原因是
为了提高SO3的吸收效率,防止形成酸雾
为了提高SO3的吸收效率,防止形成酸雾
.③燃烧1t含硫质量分数为48%的黄铁矿石,在理论上能生产98%H2SO4
1.5
1.5
t.在阅读资料时,小红发现,儿童从空气中吸入的铅量是成人吸入量的1.6~1.7倍.为了探讨这个现象,她展开了如下的研究.利用所学知识完成以下填空.
(1)课题名称为:
(2)通过取样分析,得到了下表实验数据:
分析以上实验数据,可以得出的结果是
废水样品
含Pb2+溶液
沉淀
(3)步骤中过滤需要的玻璃仪器是
(4)步骤中a操作称为
(5)通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的事
A.使用无铅汽油 B.开发新的无铅燃料
C.倡导使用铅蓄电池作动力的电动车 D.燃煤电厂、金属冶炼厂的废气经除尘后排放.
查看习题详情和答案>>
(1)课题名称为:
近地面不同高度空气含铅量的研究:
近地面不同高度空气含铅量的研究:
(2)通过取样分析,得到了下表实验数据:
| 离地面高度(m) | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
| 空气中铅的浓度(μg/m3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
离地面越低(高),含铅量越高(低)
离地面越低(高),含铅量越高(低)
造成此结果的原因可能是铅和铅化合物密度大
铅和铅化合物密度大
在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅.为了测定废水中铅的浓度,他设计了如下实验步骤:废水样品
| 化学处理 |
| K2CrO4 |
| 过滤 |
| 洗涤 |
| a |
| 称量 |
(3)步骤中过滤需要的玻璃仪器是
烧杯
烧杯
、漏斗
漏斗
和玻璃棒.(4)步骤中a操作称为
烘干
烘干
,缺少此操作,测得结果偏高
偏高
(填“偏高”、“偏低”、或“无影响”).(5)通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的事
C
C
A.使用无铅汽油 B.开发新的无铅燃料
C.倡导使用铅蓄电池作动力的电动车 D.燃煤电厂、金属冶炼厂的废气经除尘后排放.
 (2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4Cl
(2010?绵阳模拟)工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体.该反应原理可以用以下化学方程式表示,此反应是放热反应.NH3+CO2+H2O+NaCl (饱和)═NaHCO3(晶体)+NH4ClⅠ、利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
2,4,6
可选用的药品有:a.石灰石 b.生石灰 c.6mol/L盐酸 d.稀硫酸 e.浓氨水f.饱和氯化钠溶液.
①A中制备气体的离子方程式
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
,E中制备气体时所需药品是(选填字母代号)be
be
②B中溶液作用是
除去CO2中的HCl
除去CO2中的HCl
C烧杯中冰水的作用是降低温度有利于平衡向正方向移动
降低温度有利于平衡向正方向移动
.③检验D出口处是否有氨气逸出的方法是:
将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出,若试纸不变蓝,则证明没有氨气逸出.
将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出,若试纸不变蓝,则证明没有氨气逸出.
Ⅱ、该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg.再将晶体加热到质量不再变化时,称量所得粉末质量为mg.然后进行如图所示实验:

请填空:操作III的方法为
过滤
过滤
、洗涤
洗涤
、干燥
干燥
;所得晶体中碳酸氢钠的纯度为| 42n |
| 25w |
| 42n |
| 25w |
