摘要:50ml0.50mol/l盐酸与50ml0.55mol/l NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: (1)从实验装置上看.图中尚缺少的一种玻璃用品是 . (2)烧杯间填满碎纸条的作用是 . (3)大烧杯上如不盖硬纸板.求得的中和热数值 (填“偏大 “偏小 或“无影响 ). (4)若上述HCl和NaOH溶液的密度都近似为1g/cm3.中和后生成的溶液的比热容C=4.18J·(g-1·0C-1).实验起始温度为t1℃.终止温度为t2℃,则该中和反应放出热量为 KJ/mol. KJ/mol. (5)该实验常用0.50mol/lHCl 和0.55mol/l的NaOH溶液各50ml.NaOH的浓度大于HCl的浓度的作用是 .当室温低于100C时进行.对实验结果会造成较大的误差其原因是 . (6)实验中改用60ml0.50mol/l盐酸与50ml0.55mol/l NaOH溶液进行反应.与上述实验相比.所求中和热 .简述理由: . (7)用相同浓度和体积的氨水代替NaOH溶液进行上述实验.测得的中和热的数值会 (填“偏大 “偏小 或“无影响 ).
网址:http://m.1010jiajiao.com/timu3_id_263630[举报]
50mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是______________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由____________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL0.50mol/LCH3COOH溶液代替盐酸进行上述实验,测得的中和热的数值会____(均填 “偏大”“偏小”或“无影响”)。
查看习题详情和答案>>
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由____________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50mL0.50mol/LCH3COOH溶液代替盐酸进行上述实验,测得的中和热的数值会____(均填 “偏大”“偏小”或“无影响”)。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题
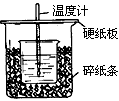
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值______________(填“偏大、偏小、无影响”)
(4)实验中改用60mL 0.50mol·L-1的盐酸跟50mL 0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________ (填“相等”或“不相等”),简述理由:________________________________
查看习题详情和答案>>
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值______________(填“偏大、偏小、无影响”)
(4)实验中改用60mL 0.50mol·L-1的盐酸跟50mL 0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________ (填“相等”或“不相等”),简述理由:________________________________
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大、偏小、无影响”)
(4)如果用60 ml 0.50 mol/L盐酸与50mL 0.55 mol/L Na OH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热___________(填“相等、不相等”), 简述理由
_____________________
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热___________的数值会 (填“偏大”、“偏小”、“无影响”)。
查看习题详情和答案>>
(2)烧杯间填满碎纸条的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大、偏小、无影响”)
(4)如果用60 ml 0.50 mol/L盐酸与50mL 0.55 mol/L Na OH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热___________(填“相等、不相等”), 简述理由
_____________________
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热___________的数值会 (填“偏大”、“偏小”、“无影响”)。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________________。
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大、偏小、无影响”)
(4)该同学所用的装置,你认为合理吗?说明你的观点。依据你的看法,有几点说几点,不一定全部回答。
①__________________________________________________________。
②__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
(5)在实验过程中,该同学没有找到缺少的那一件用品,就用细铜丝自己做了一个,你认为可以吗?阐明你的观点________________________________。
(6)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________ (填“相等”或“不相等”),简述理由:__________________。
查看习题详情和答案>>
(2)烧杯间填满碎纸条的作用是_________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大、偏小、无影响”)
(4)该同学所用的装置,你认为合理吗?说明你的观点。依据你的看法,有几点说几点,不一定全部回答。
①__________________________________________________________。
②__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
(5)在实验过程中,该同学没有找到缺少的那一件用品,就用细铜丝自己做了一个,你认为可以吗?阐明你的观点________________________________。
(6)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________ (填“相等”或“不相等”),简述理由:__________________。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____________(填“偏大.偏小.无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
_____________ (填“相等.不相等”),所求中和热_____________(填“相等.不相等”),简述理由
__________________________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
_____________;(填“偏大”.“偏小”.“无影响”)。
查看习题详情和答案>>
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_____________(填“偏大.偏小.无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
_____________ (填“相等.不相等”),所求中和热_____________(填“相等.不相等”),简述理由
__________________________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
_____________;(填“偏大”.“偏小”.“无影响”)。