网址:http://m.1010jiajiao.com/timu3_id_263516[举报]
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与Cu属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含三种元素,则其中心原子是
(1)写出制备 NF3的化学反应方程式:______.
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是______.
(3)与Cu属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为______.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含三种元素,则其中心原子是______,配位数为______.
 (2012?南京模拟)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到.
(2012?南京模拟)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到.(1)NF3中氮原子的杂化方式为
(2)N、F两种元素的氢化物稳定性比较,NH3
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式
(4)氯化铜溶液中加入过量氨水,可以生成四氨合铜络离子,写出该反应的化学方程式
(5)元素A基态原子的核外电子排布式为1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如图,该离子化合物的化学式为
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:__________。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是_______________
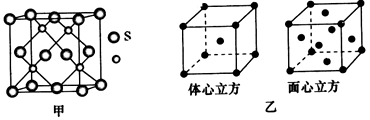
(3)与铜属于同一周期的过渡元素,且各电子层均无未成对电子,该元素的基态原子核外电子排布式为____________;若该元素的硫化物具有如图甲所示的晶胞结构,则该晶胞中S2-的配位数为__________。若该金属单质的晶体在不同温度下有两种不同的堆积方式,其晶胞结构分别如图乙所示,则两晶胞中实际含有的原子个数之比为____________。
②T元素最可能是_____区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为_______,其中心原子的杂化方式为______。
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看习题详情和答案>>