摘要: 下列说法错误的是: A.酸雨的pH小于5.6 B.医用酒精的体积分数是75% C.煤和天燃气都是纯净物 D.汽油是C5-C11的烃的混合物
网址:http://m.1010jiajiao.com/timu3_id_262404[举报]
氮气与氢气反应生成氨气的平衡常数见表:
(1)工业上合成氨的温度一般控制在500℃,原因是 .
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为 mol/(L?min).
(3)下列说法能表明该反应达到平衡的是 .
A.气体的平均分子量不再变化
B.密闭容器内的压强不再变化
C.v(N2)=2v(NH3)
D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是 .
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是 .
A.溶液的pH增大 B.氨水的电离度减小 C.(OH-)减小 D.(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使(NH4+)与(Cl-)比值变大的是 .
A.加入固体氯化铵 B.通入少量氯化氢 C.降低溶液温度 D.加入少量固体氢氧化钠.
查看习题详情和答案>>
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
(2)在2L密闭容器中加入1mol氮气和3mol氢气,进行工业合成氨的模拟实验,若2分钟后,容器内压强为原来的0.8倍,则0到2分钟,氨气的反应速率为
(3)下列说法能表明该反应达到平衡的是
A.气体的平均分子量不再变化
B.密闭容器内的压强不再变化
C.v(N2)=2v(NH3)
D.气体的密度不再变化
(4)下列措施,既能加快该反应的反应速率,又能增大转化率的是
A.使用催化剂 B.缩小容器体积 C.提高反应温度 D.移走NH3
(5)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是
A.溶液的pH增大 B.氨水的电离度减小 C.(OH-)减小 D.(NH4+)减小
(6)将氨水与盐酸等浓度等体积混合,下列做法能使(NH4+)与(Cl-)比值变大的是
A.加入固体氯化铵 B.通入少量氯化氢 C.降低溶液温度 D.加入少量固体氢氧化钠.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H= .
(2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.

①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 等必须相同.
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如图1所示.空燃比约为 时,催化剂对汽车尾气的催化效果最好.
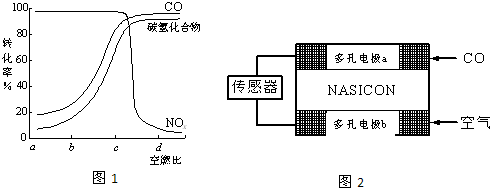
(3)CO分析仪以燃料电池为工作原理,其装置如2图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.
下列说法错误的是 .
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
查看习题详情和答案>>
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=
(2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.

①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如图1所示.空燃比约为

(3)CO分析仪以燃料电池为工作原理,其装置如2图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.
下列说法错误的是
A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高.
密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
25℃时初始浓度/mo1·L-1 |
0.1 |
0.2 |
0 |
|
25℃时平衡浓度/mo1·L-1 |
0.05 |
0.05 |
0.1 |
|
50℃时平衡浓度/mo1·L-1 |
0.06 |
0.08 |
0.08 |
下列说法错误的是 ( )
A.该反应是放热反应[来源:ZXXK.COM]
 B.该反应可表示为X+3Y 2Z
B.该反应可表示为X+3Y 2Z
C.增大压强使平衡向生成Z的方向移动,X浓度减小
D.反应达到平衡时,Y的分解速率是Z的分解速率的1.5倍
查看习题详情和答案>>
N2 (g)+3H2 (g)  2NH3(g)? ΔH=-92.4 kJ·mol-1。????????????? 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。
2NH3(g)? ΔH=-92.4 kJ·mol-1。????????????? 1L密闭恒容容器中,反应体系中各物质浓度随时间变化的曲线如图示。
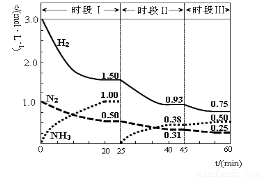
下列说法错误的是:
A.前20分钟反应物的转化率为50%
B.第25分钟改变的条件是将NH3从反应体系中分离出去
C.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数增大
D.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度
查看习题详情和答案>>
下图为元素周期表中短周期的一部分,下列说法错误的是
| X | Y |
| Z | W |
A.W的原子序数可能是Y的两倍
B.单质的活泼性可能是Y>Z
C.气态氢化物的稳定性X<Y
D.Y、W的最高价氧化物对应水化物可能均为强酸 查看习题详情和答案>>