网址:http://m.1010jiajiao.com/timu3_id_261633[举报]
体。回答下列问题:
(1)写出下列元素符号:M______________,Z______________,W______________。
(2)Y元素常见的两种同素异形体的名称是______________和______________。
(3)M的单质与X的最高价氧化物水化物反应的化学方程式为______________________。
(4)元素W的原子序数比同族上一周期元素的原子序数大____________(填数字),而元素Z的原子序数比同族上一周期元素的原子序数大___________(填数字)。
查看习题详情和答案>>(1)X能形成多种常见单质,其熔点最低的单质为___晶体;在熔点最高的两种单质中,X的杂化方式分别为 ____、____。
(2)X、Y分别与氢元素形成的化学键的极性大小为X-H____Y-H,键能大小为X-H____Y-H(填“<”、 “>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有 I3、I4、I5…,推测Z元素的电离能突增应出现在第___电离能。
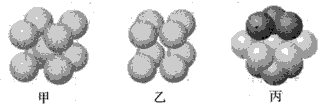
(4)W原子的电子排布式为___;W基态原子有___种不同形状的原子轨道;W晶体的配位数为____;下图___表示的是W晶体中原子的堆积方式(填“甲”、“乙”或“丙”)。
原子序数依次增大的五种短周期元素X、Y、Z、Q、R,已知X与Q同主族,Y、Z原子序数之比为3:4,Z的最外层电子数是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态。
(1)表示Y元素中质子数与中子数相等的同位素符号是 。
(2)Q与Z形成的原子个数比为1:1的化合物的电子式是 。
(3)A+B→C+D+H2O为中学化学中常见的反应形式,A、B、C、D均为由上述五种元素组成的单质或化合物。
①如A为NaOH、B为CO2时,可写成aNaOH + bCO2 = cNa2CO3 + d NaHCO3 + nH2O,a与b的物质的量之比应满足的关系是 。现向l00 mL、3 mol/L的NaOH溶液中缓慢通入标准状况下4.48 L的CO2气体,用l个化学方程式表示以上反应
(化学计量数为最简整数),此时溶液中各种离子物质的量浓度由高到低的排列顺序是_ _。
②请任写一个符合A+B→C+D+H2O形式的氧化还原反应方程式,其中C、D均为盐
。
查看习题详情和答案>>(共16分)现有原子序数依次增大的M、X、Y、Z、W五种主族元素,它们处于周期表中相邻的三个周期。它们之间满足如下关系:①X、Y同族,Z、W同周期,且X的氢化比Y的氢化物沸点高;②Y元素可形成氯化物![]() ,其分子中各原子最外层电子数之和为26;③Z与M、W均可形成ZM2、ZW2型的离子化合物,且ZM2可与水反应生成可燃性气体。回答下列问题:
,其分子中各原子最外层电子数之和为26;③Z与M、W均可形成ZM2、ZW2型的离子化合物,且ZM2可与水反应生成可燃性气体。回答下列问题:
(1)写出下列元素符号:M ,Z ,W 。
(2)Y元素常见的两种同素异形体的名称是 和 。
(3)![]() 与水反应生成两种酸的化学方程式为 _____________ 。
与水反应生成两种酸的化学方程式为 _____________ 。
(4)元素W的原子序数比同族上一周期元素的原子序数大 (填数字),而元素Z的原子序数比同族上一周期元素的原子序数大 (填数字)。
查看习题详情和答案>>(10分)原子序数依次增大的五种短周期元素X、Y、Z、Q、R,已知X与Q同主族,Y、Z原子序数之比为3:4,Z的最外层电子数是Q的最外层电子数的6倍,R为同周期中原子半径最小的元素(稀有气体元素除外),X与R形成的化合物常温下为气态。
(1)表示Y元素中质子数与中子数相等的同位素符号是 。
(2)Q与Z形成的原子个数比为1:1的化合物的电子式是 。
(3)A+B→C+D+H2O为中学化学中常见的反应形式,A、B、C、D均为由上述五种元素组成的单质或化合物。
①如A为NaOH、B为CO2时,可写成aNaOH + bCO2 = cNa2CO3 + d NaHCO3 + nH2O,a与b的物质的量之比应满足的关系是 。现向l00 mL、3 mol/L的NaOH溶液中缓慢通入标准状况下4.48 L的CO2气体,用l个化学方程式表示以上反应
(化学计量数为最简整数),此时溶液中各种离子物质的量浓度由高到低的排列顺序是_ _。
②请任写一个符合A+B→C+D+H2O形式的氧化还原反应方程式,其中C、D均为盐
。
查看习题详情和答案>>