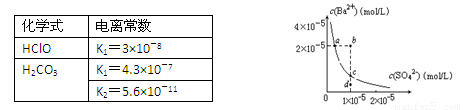
摘要:16.某温度时.将烧杯中的x gKNO3饱和溶液恒温下蒸发部分溶剂.然后再将烧杯中的物质逐渐升温(假设升温时溶剂没有损失).能够正确表示此过程中KNO3溶液溶质的质量分数关系的示意图是
网址:http://m.1010jiajiao.com/timu3_id_261347[举报]
(14分)某温度时,将0.200mol的A气体充入2L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下数据:
试填空:
(1)该反应的化学方程式为
(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
该反应的平衡常数k=
.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
①温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
查看习题详情和答案>>
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为
A(g)=2B(g)
A(g)=2B(g)
,表中c2>
>
c3、a=
=
b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是0.2
0.2
mol?L-1.(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
;该反应的平衡常数k=
| 16 |
| 3 |
| 16 |
| 3 |
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).②提高氢碳比[n(H2)/n(CO2)],K值
不变
不变
(填“增大”、“减小”、或“不变”).(14分)某温度时,将0.200mol的A气体充入2L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下数据:
试填空:
(1)该反应的化学方程式为______,表中c2______c3、a______b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是______mol?L-1.
(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
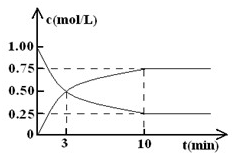
(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;
该反应的平衡常数k=______.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
①温度升高,K值______(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”).
查看习题详情和答案>>
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为______,表中c2______c3、a______b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是______mol?L-1.
(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;
该反应的平衡常数k=______.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
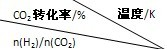 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”).
某同学欲制得450mL 0.5mol?L-1的NaOH溶液,而实验室只有100mL、250mL、500mL、1000mL四种规格的容量瓶,请你帮助他完成实验,并填写下列空白.
(1)他应选择的容量瓶为
(2)具体的操作如下:
(a)用托盘天平准确称取
(b)将烧杯中的NaOH加适量的水溶解;
(c)将NaOH溶液用玻璃棒引流转移到容量瓶;
(d)摇动容量瓶,使溶液混合均匀;
(e)定容;
(3)问题与思考
(a)称NaOH固体时,NaOH放在
(b)上述配制过程中,NaOH会吸收空气中的一种气体而使浓度降低,该气体是
(c)如何检验NaOH溶液是否变质?
查看习题详情和答案>>
(1)他应选择的容量瓶为
500mL
500mL
.(2)具体的操作如下:
(a)用托盘天平准确称取
10
10
克NaOH固体;(b)将烧杯中的NaOH加适量的水溶解;
(c)将NaOH溶液用玻璃棒引流转移到容量瓶;
(d)摇动容量瓶,使溶液混合均匀;
(e)定容;
(3)问题与思考
(a)称NaOH固体时,NaOH放在
左
左
盘(填左、右)的烧杯
烧杯
中(填仪器名称)(b)上述配制过程中,NaOH会吸收空气中的一种气体而使浓度降低,该气体是
CO2
CO2
,写出有关的化学方程式CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.(c)如何检验NaOH溶液是否变质?
取少许样品,向其中加入足量稀盐酸,如有气泡则变质.
取少许样品,向其中加入足量稀盐酸,如有气泡则变质.
. MgCl2+6H2O
MgCl2+6H2O