摘要:5.常温下.下列各组物质反应时能产生氢气的是 ( ) A.铁和浓硫酸 B.铜和稀硫酸 C.锌和稀盐酸 D.铁和浓硝酸
网址:http://m.1010jiajiao.com/timu3_id_261054[举报]
(2013?绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
请回答下列问题:
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
(3)当只改变温度或压力时,反应⑤有如图所示的变化:
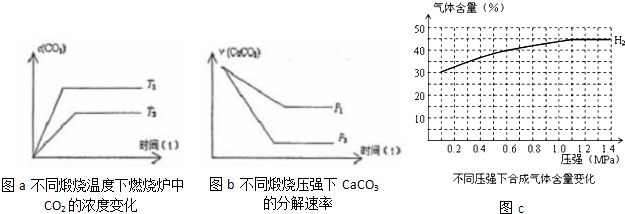
图a推知T1
图b推知P1
(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
查看习题详情和答案>>
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
-87.9
-87.9
kJ?mol-1(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
0.45
0.45
mol.(3)当只改变温度或压力时,反应⑤有如图所示的变化:

图a推知T1
>
>
T2(填“>”、“<”、“=”),若温度升高,平衡常数K值增大
增大
(填“增大”、“减小”、“不变”)图b推知P1
<
<
P2(填“>”、“<”、“=”),压强增大,CaCO3的分解率减小
减小
(填“增大”、“减小”、“不变”)(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
BC
BC
(用相关编号填写)A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
.