摘要:氨水中有下列平衡:NH3•H2O NH4++OH-.当其它条件不变时.改变下列条件.可使c(NH4+)减小的是 A.加入NaOH固体 B.通入HCl气体 C.加入NH4Cl固体 D.加入同浓度氨水
网址:http://m.1010jiajiao.com/timu3_id_260858[举报]
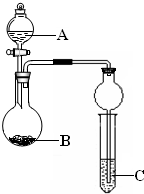 某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,
原因是
在氨水中有下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;
在氨水中有下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;
(结合离子方程式回答).一段时间后,观察到试管中的现象是有白色沉淀产生
有白色沉淀产生
,发生反应的离子方程是
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是
CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑
CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑
,能得到的相应结论是醋酸酸性强于碳酸;
醋酸酸性强于碳酸;
;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚
不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚
.化学平衡移动原理,同样也适用于其他平衡.
(1)已知在氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH- 向氨水中加入MgCl2固体时,平衡向 移动(填“左”或“右”),OH-的浓度 (填“增大”或“减小”),向浓氨水中加入少量NaOH固体,平衡向 移动(填“左”或“右”),此时发生的现象是 .
(2)氯化铁水解的离子方程式为 ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 ,同时有红褐色沉淀生成,其原因是 .
查看习题详情和答案>>
(1)已知在氨水中存在下列平衡:NH3+H2O?NH3?H2O?NH4++OH- 向氨水中加入MgCl2固体时,平衡向
(2)氯化铁水解的离子方程式为