摘要:22.在100mL bmol/L的AlCl3溶液中加入等体积a mol/L的NaOH溶液. (1)当a.b满足 条件时无沉淀生成. (2)当a≤3b时.生成Al(OH)3的物质的量为 . (3)当a=0.2, b=0.1 时生成Al(OH)3的质量为多少?(该小题写出必要的计算过程) 高二年级化学上学期期末质量检查
网址:http://m.1010jiajiao.com/timu3_id_257657[举报]
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大
(2)哪一段时段的反应速率最小
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)
查看习题详情和答案>>
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
2~3 min
2~3 min
,原因是该反应是放热反应,温度升高,反应速率加快
该反应是放热反应,温度升高,反应速率加快
.(2)哪一段时段的反应速率最小
4~5min
4~5min
,原因是盐酸的浓度减小,反应速率减慢
盐酸的浓度减小,反应速率减慢
.(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
0.1mol/L.min
0.1mol/L.min
.(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)
AB
AB
.下表是元素周期表的前三周期,回答下列问题:

(1)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的化学方程式:①
(2)a、b、c、d、e的氢化物的沸点直角坐标图如图所示,序号“5”氢化物的化学式为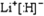
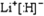 .
.
查看习题详情和答案>>

(1)f、g元素的单质共5.0g在100mL水中完全反应,生成的溶液中只含有一种溶质,分步写出发生反应的化学方程式:①
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
②2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.所得溶液的物质的量浓度最大值为1mol/L
1mol/L
.(液体的体积变化忽略不计)(2)a、b、c、d、e的氢化物的沸点直角坐标图如图所示,序号“5”氢化物的化学式为
CH4
CH4
,序号“1”氢化物的电子式为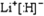
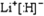

 实验题:某实验小组用如图所示装置进行铜与浓硫酸反应的实验探究.
实验题:某实验小组用如图所示装置进行铜与浓硫酸反应的实验探究.(1)写出甲中反应的化学方程式:
Cu+2H2SO4
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4
CuSO4+SO2↑+2H2O
.
| ||
(2)乙试管口的棉花应沾有的试剂是
NaOH溶液
NaOH溶液
,其作用是吸收未反应的SO2,防止污染空气
吸收未反应的SO2,防止污染空气
.(3)实验小组成员观察乙试管内液体变化是
品红溶液褪色
品红溶液褪色
.(4)充分反应后,若甲试管中有铜片剩余,继续向甲中加入NaNO3溶液,发现铜片溶解,此反应的离子方程式为
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(5)在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
D
D
.(填字母)A.40.32L B.30.24L C.20.16L D.13.44L.