摘要:10.常温下将稀NaOH溶液与稀醋酸溶液混合.不可能出现的结果是 ( ) A.pH>7, 且c(Na+)>c(OH-)> c(CH3COO-)> c(H+) B.pH>7, 且c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-) C.pH<7, 且c(CH3COO-) > c(H+)> c(Na+)> c(OH-) D.pH=7, 且c(CH3COO-)>c(Na+)>c(OH-)= c(H+)
网址:http://m.1010jiajiao.com/timu3_id_256648[举报]
常温下,下列叙述正确的是( )
| A.某醋酸溶液的pH=a,若将此溶液稀释l0倍后溶液的pH=b,则a>b |
| B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D.若lmL pH=1的盐酸与l00mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是
A.在醋酸的稀溶液中存在电离平衡:CH3COOH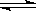 CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大
CH3COO-+H+,加水一定能使电离平衡右移,氢氧根离子浓度增大
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液: 2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14 -a
查看习题详情和答案>>