摘要:原电池工作原理:以Cu-Zn原电池为例. 负极:Zn-2e=Zn2+被氧化.锌板不断溶解, 正极:2H+2e=H2↑被还原.表面置出气泡. 电子流动方向:负极. Cu-Zn原电池发生的总反应跟锌和酸的反应是一致的.但电子却经外接导线发生迁移.形成持续的电流.使化学能转化为电能. 构成原电池的反应必须能自发地进行氧化还原反应.从理论上讲.任何一个氧化还原反应都可设计成原电池.只不过要求氧化反应和还原反应必须在两极上分别进行.使与两极连接的导线里.产生持续电流. [难题巧解点拨] 例1:把a,b,c,d4块金属片浸入稀硫酸中.用导线两两相连组成原电池.若a,b相连时.a为负极,c,d相连时.d上产生大量气泡,a.c相连时.电流由c经导线流向a,b.d相连时.电子由d经导线流向b.则此4种金属的活动性由强到弱的顺序为( ) A.a>b>c>d B.a>c>d>b C.c >a>b>d D.b>d>c>a 分析:根据原电池原理.较活泼的金属为负极.被氧化溶解,相对不活泼的金属为正极.冒气泡或析出金属.电子由负极经外电路流向正极.电流方向与电子方向相反等进行推断可得: a>c>d>b 答案为B. 例2 下列装置能够组成原电池.产生电流的是( ) 分析:根据构成原电池的条件必须同时满足:(1)要有活泼性不同的两个电极.要有导线.能形成闭合回路. 用此条件进行判断:在A中两个电极的金属相同.不符合条件.在(D)中没有电解质溶液.乙醇是非电解质.故只有B.C符合条件 答案:BC 例3:银锌电池是广泛用作各种电子仪器的电源.它的充电和放电过程可表示为: 2Ag+Zn(OH)2 Ag2O+Zn+2H2O 此电池放电时.负极上发生反应的物质是( ) A.Ag B.Zn(OH)2 C.Ag2O D.Zn 分析:根据原电池工作原理.负极上发生氧化反应.元素化合价会升高.所以在放电过程中被氧化的是Zn.即Zn为负极. 答案:为D [命题趋势分析] 常考知识点:
网址:http://m.1010jiajiao.com/timu3_id_256504[举报]
|
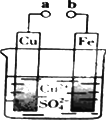
某小组为研究原电池工作原理,设计如图装置.下列叙述不正确的是
| |
| [ ] | |
A. |
a和b不连接时,铁片上会有金属铜析出 |
B. |
a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu |
C. |
无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
D. |
无论a和b是否连接,该装置中发生的反应速率是一样的 |
下列叙述中完全正确的一组是( )
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA
④常温常压下,16g O3所含的原子数为NA
⑤1mol C10H22分子中共价键总数为31NA
⑥1mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L水中含分子数为NA.
①常温常压下,1mol甲基(-CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2gH2,则电路通过电子0.2NA
③在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA
④常温常压下,16g O3所含的原子数为NA
⑤1mol C10H22分子中共价键总数为31NA
⑥1mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L水中含分子数为NA.
查看习题详情和答案>>
工业制硫酸铜不是直接用铜和浓硫酸反应,而是将粗铜(含少量银)浸入稀硫酸中,并不断从容器下部吹入细小的空气泡.有关该制备方法的叙述中,不正确的是( )
| A、该方法应用了原电池工作原理 | B、该方法不产生污染大气的二氧化硫 | C、该方法提高了硫酸的利用率 | D、该方法提高了铜的利用率 |